您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-03-31 10:32
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
中生制药RET抑制剂获批临床。中生制药旗下江苏正大丰海开发的1类新药FHND5071片获国家药监局临床默示许可,拟用于晚期实体瘤的治疗。FHND5071是基于计算机辅助药物设计和传统药物设计手段开发的全新RET选择性抑制剂,具有持久的体内药效、较高的肿瘤组织分布以及更低的有效剂量,并且可以透过血脑屏障,对于原发或转移至中枢神经系统的肿瘤具治疗潜力。目前该产品已向FDA提交IND申请。
国内药讯
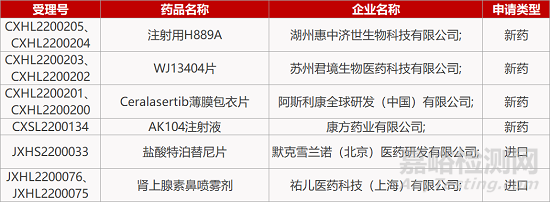
1.默克c-Met抑制剂在华报产。默克c-Met抑制剂特泊替尼片(tepotinib)的上市申请获CDE受理。在一项用于治疗MET ex14跳跃突变晚期非小细胞肺癌(NSCLC)的关键II期VISION研究中,tepotinib单药达到43%的ORR。2020年3月,Tepotinib已在日本获得全球首批,成为全球首个获批用于治疗MET基因突变晚期非小细胞肺癌(NSCLC)的口服c-Met抑制剂。
2.康诺亚IL-4Rα单抗II期临床成功。康诺亚IL-4Rα单抗CM310治疗慢性鼻窦炎伴鼻息肉的II期临床(CM310NP001)达到全部疗效终点。与安慰剂相比,CM310治疗组16周时患者的双侧鼻内镜息肉评分(NPS)和鼻塞评分(NCS)较基线变化均显著改善,NPS和NCS较基线分别降低2.32(vs0.19,P<0.0001)和1.23(vs0.30,P<0.0001),而且CM310不良事件 (TEAE)发生率与安慰剂相当。详细数据将于国际学术期刊或学术会议上公布。
3.德琪第二代SINE获批国际II期临床。德琪医药核输出抑制剂(SINE)ATG-016(Eltanexor)获国家药监局临床试验默示许可。这是一项国际II期临床研究(KCP-8602-801),由合作公司Karyopharm发起的旨在评估ATG-016在6个复发难治性肿瘤队列的安全性、耐受性和有效性的开放性I/II期临床。德琪医药将在中国为ATG-016单药用于治疗高危骨髓增生异常综合征(MDS)的"队列F"II期部分招募患者。
4.嘉和FIC靶向三抗报IND。嘉和生物1类生物制品注射用GB263T的临床试验申请获CDE受理。GB263T是全球首个EGFR/c-Met/c-Met三特异性抗体,针对EGFR和两个不同c-Met表位,可同时抑制原发性及继发性EGFR突变及c-Met信号通路。全球范围内同时靶向EGFR和c-Met的抗体药物只有强生Amivantamab(JNJ-372,Rybrevant) 获批上市,是全球首款用于EGFR外显子20插入突变转移性非小细胞肺癌的治疗药物。
5.杭州嘉因SMA基因疗法报IND。嘉因生物自主研发的1类生物药EXG001-307注射液的临床试验申请获CDE受理。EXG001-307是一款基因替代疗法,拟用于治疗1型脊髓性肌萎缩症(SMA),与诺华已获批Zolgensma的作用机制和用法相似,有望一次给药长期有效。3月26日,EXG001-307已在浙江大学医学院附属儿童医院开展的一项IIT(研究者发起的)临床研究完成首例受试者给药,目前安全性及耐药性均表现良好。
6.翰森制药2021年创新药收入增长169%。3月29日,翰森制药公布2021年度业绩报告。2021年度公司营收99.35亿元,同比增长14.3%;溢利27.13 亿元,同比增长5.6%;研发投入17.97亿元,同比大增43.5%,占营收比例18.1%。报告期内,阿美替尼、氟马替尼、吗林硝唑、洛塞那肽、艾米替诺福韦等创新药销售收入42.02亿元,同比增长168.9%,占收入比例从2020年度的18.0% 上升至42.3%。
国际药讯
1.辉瑞新冠疫苗第四针获批EUA。FDA扩大辉瑞与BioNTech开发的COVID-19疫苗的紧急使用范围,用于50岁及以上的人群在第一次加强针至少四个月后进行第二剂加强针接种,第二剂加强针的配方和强度与之前疫苗剂量相同。FDA同时还授权该疫苗针对12岁及以上,被确定患有某些免疫功能低下,已接受过任何一种已获批的COVID-19加强针的个人进行第二剂加强针接种。
2.武田HAE预防性疗法在日本获批。日本卫生部批准武田Takhzyro(lanadelumab)300mg皮下注射液,用于预防性治疗12岁以上遗传性血管性水肿(HAE)患者。在临床试验中,与安慰剂相比,Takhzyro显著降低患者HAE每月平均发作次数,每两周注射和每四周注射使HAE每月平均发作次数降幅分别达到87%和73%(调整后P<0.001)。Takhzyro已于2018年8月和11月获批在美国和欧盟上市,是首个获批用于HAE的单抗药物。
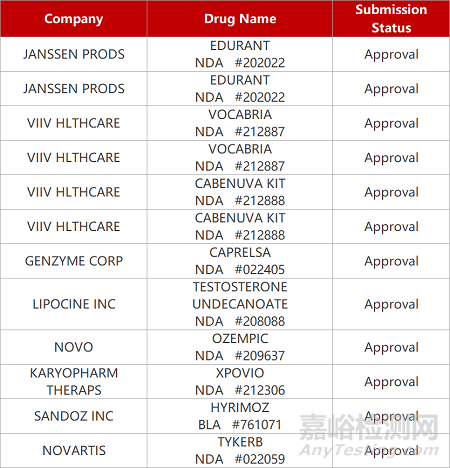
3.FDA批准长效HIV复方用于青少年。ViiV Healthcare开发的HIV药物Cabenuva(卡博特韦/利匹韦林)获FDA批准扩展适用范围,用于治疗已实现病毒学抑制(HIV RNA<50拷贝/毫升)的HIV-1青少年感染者(年龄≥12岁、体重≥35公斤)。Cabenuva是全球首款也是唯一一款获批的完整长效HIV治疗方案,目前已被批准每月一次或每2个月一次,用于治疗实现病毒学抑制的HIV-1成人和青少年患者。Cabenuva目前提供2种可注射药物的联合包装。
4.辉瑞S1P调节剂第二项Ⅲ期临床积极。辉瑞口服选择性1-磷酸鞘氨醇(S1P)受体调节剂etrasimod治疗中重度溃疡性结肠炎(UC)的第二项Ⅲ期临床ELEVATE UC 52达到试验的共同主要终点。Etrasimod治疗组患者在第12周和52周时获得统计显著临床缓解改善;所有关键性次要终点也获得统计显著改善。详细结果将发表在科学期刊上。辉瑞预计今年向FDA递交上市申请。
5.赛诺菲逾60亿美元开发IgM抗体。赛诺菲与IGM Biosciences公司将利用后者独有的IgM抗体平台,针对三个肿瘤学靶点和三个免疫学/炎症靶点,合作开发激动剂疗法。根据协议,IGM将获得1.5亿美元的前期付款,每个肿瘤学靶点可能高达9.4亿美元的里程碑付款,以及每个免疫学/炎症靶点可能高达10.65亿美元的里程碑付款。在肿瘤学合作方面,IGM将负责研发直至获得FDA或EMA的监管批准,赛诺菲负责产品后续开发和商业化。在免疫学/炎症合作方面,IGM将负责研发直至完成Ⅰ期临床,赛诺菲将负责后续开发。
6.渤健/Ionis终止ALS新药I期试验。渤健与Ionis Pharmaceuticals联合开发的反义寡核苷酸药物BIIB078,在治疗C9orf72相关的肌萎缩侧索硬化症(ALS)的I期临床中没有显示出临床益处。与安慰剂相比,BIIB078 60mg治疗组患者病情缓解没有一致性差异;BIIB078 90mg剂量组患者在次要终点方面的病情恶化趋势大于安慰剂组。BIIB078总体耐受性良好,不良事件(AE)的严重程度大多为轻度至中度。目前渤健和Ionis已终止BIIB078的临床开发。
医药热点
1.湖北将试点儿童近视防控门诊。近日,武汉大学人民医院(湖北省人民医院)在湖北省内公立三甲医院首开近视防控门诊。武汉大学人民医院眼科中心将作为湖北省儿童青少年近视防治中心牵头单位,在全省17个地市州103个县区启动“儿童青少年近视防控门诊”建设试点,挑选50个县市区作为首批试点。近视防控门诊不仅为近视以及斜、弱视患儿精准规范地验光配镜,并进行科学的诊断治疗,还将为儿童青少年提供用眼指导、屈光发育档案建立、视力跟踪监测、视力矫治等视力预防保健服务。
2.上海启动预防性消毒专项行动。为切断新冠疫情传播途径,上海市启动一项为期一个月的全市重点场所预防性消毒专项行动。专项行动聚焦办公楼宇、建筑工地、公共场所、交通工具、家庭、农贸市场、大型商场、社区、学校、养老机构等十大重点场所,通过“人-物-环境预防”,防止疫情扩散,筑牢全社会疫情防控屏障。
3.“十四五”中医药发展规划出台。3月29日,国务院办公厅印发《“十四五”中医药发展规划》,部署建设优质高效中医药服务体系,提升中医药健康服务能力等十方面重点任务。到2025年,建设130个左右中医特色重点医院;力争实现全部社区卫生服务中心和乡镇卫生院设置中医馆;建设35个左右国家中医疫病防治基地;制定并推广20个中医治未病干预方案;建设50个左右中西医协同“旗舰”医院,形成100个左右中西医结合诊疗方案或专家共识。
评审动态
2. FDA新药获批情况(北美03月29日)

来源:药研发


