您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-06 15:00
溶出度是指药物从制剂在规定介质中溶出的速度和程度,药物只有从制剂中释放出来,经过人体吸收进入血液循环后,才能发挥药效。因此,溶出度不仅是制剂质量控制的重要指标,更是药品有效性的内在保证。《中国药典》2020年版四部0931通则即溶出度与释放度测定法共收载了7种溶出测定方法,分别为篮法、桨法、小杯法、桨碟法、转筒法、流池法、往复筒法。其中流池法为新增溶出度测定法。除此之外,美国药典、欧洲药典及日本药局方均已收载流池法。
01流池法基本结构及工作原理
《中国药典》2020年版对流池法的形状结构及各项参数均做出详细规定,如流通池尺寸、内径、标准流速及脉冲频率等。详细参数见图1(来源于《中国药典》2020年版)。流通池中各部件位置均已固定,几乎不需要机械校正,使用及维护较为简单。作为一种新型的溶出度测定方法,流池法的工作原理为使用恒流泵将溶出介质以适宜流速泵入流通池中与待测样品接触,通过介质的流动来溶解样品,样品溶液经流通池上端过滤后流出,测定按照预设时间点或时间段收集的样品溶液中的药物浓度。
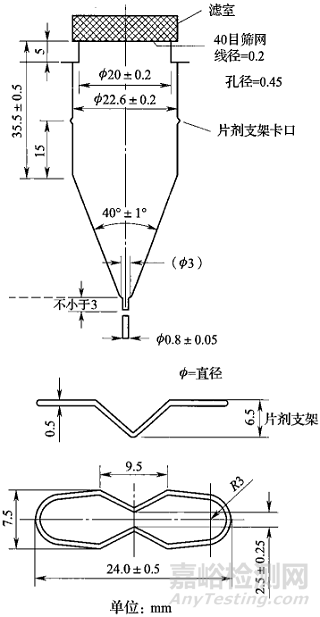
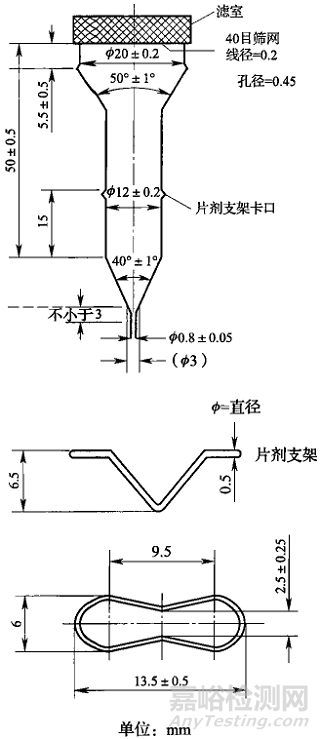
图1 用于片剂及胶囊剂的大流通池(左)及小流通池(右)
影响流池法溶出仪的重要因素主要有输液泵、流速曲线及过滤系统。
目前流通池系统常用两种输液泵即陶瓷活塞泵和玻璃管双通道注射泵。陶瓷活塞泵的优点是无阀体,耐磨损无耗材稳定耐用,尤其适合长效制剂,活塞泵内置自动校验模式可方便快速校验泵的流速,从而保证实验结果的准确性和重现性;且可每个泵运行不同的流速,大大提高研发效率。而玻璃管双通道注射泵使用的是塑料密封圈,不耐磨损,高频使用下密封圈易磨损出现密封性不好、漏液和流速不准等问题。深圳市华溶分析仪器有限公司是国内首家将活塞泵流池法溶出仪系统商品化的公司。
各国药典中都规定流速曲线应为正弦曲线。活塞泵从原理和设计上天然地可实现正弦流速曲线。双通道注射泵最初设计是实现无脉冲曲线,通过软件的计算模拟理论上能实现正弦曲线,而实际操作较难控制和实现正弦曲线,会经常出现三角脉冲曲线或梯形脉冲曲线。华溶流池法采用活塞泵可实现开闭环自动切换设计,并可进行正弦流速曲线的验证。
此外,华溶流池法具有多重过滤系统,确保样品的不溶颗粒被逐级过滤,且可以降低系统压力,还配有七个压力传感器,可实时监控池体压力并预测流速的准确性;当出现高压报警时,泵停止运转以保护活塞泵,实验过程中实时记录各个池体的压力变化曲线,可通过分析压力曲线分析制剂溶出过程和溶出结果。
02流池法的优点
根据溶出介质是否循环可将流池法系统分为闭环式系统和开环式系统。闭环式流通池系统(图2)中的溶出介质流过流通池后再返回溶出介质库,与传统溶出方法相似,溶出介质体积固定,药物溶出浓度随时间的增加而增大,直至溶出介质中药物浓度不再改变。该方法解决了桨法中待测样品的黏附、漂浮或堆积等难题,适合介质量较少且不易检测的药物释放度的测定,不仅适用于片剂、胶囊剂、颗粒剂等传统剂型,还可应用于混悬剂、骨架片、纳米粒、微球、栓剂等多种新型递药系统。
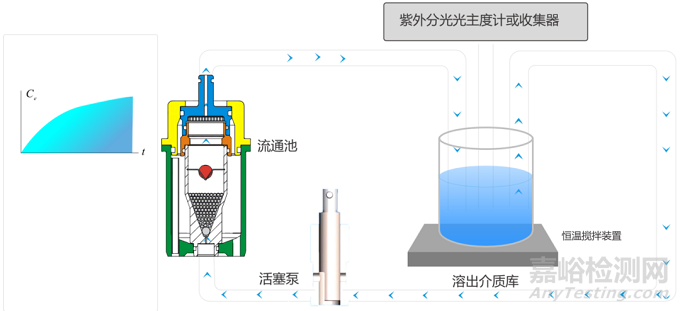
图2 闭合式流通池系统示意图
开环式流通池系统(图3)中的溶出介质流过流通池后不再返回,保证了被测样品时刻暴露于新鲜的溶出介质中,始终维持漏槽条件,在不引入增溶剂下可以满足难溶性药物的溶出测定,适合需要大量溶出介质的实验。开环式系统配有溶媒选择器,可在实验过程中自动切换至不同pH的溶媒,用于模拟胃肠道pH变化的环境。目前,已上市药物中40%为BCS二类和四类药物,开发中的新型药物分子中有90%为BCS二类和四类药物即低溶解度高渗透性药物。因此,开环式流池法对新药开发意义重大。除上述优点外,流池法较传统的篮法及桨法具有更缓和的流体动力学性质,可以一定程度上区分由于溶出过快而体现不出差异的样品。此外,流池法的载样方式更为灵活,投药位置相对固定,极大地提高了实验的重现性。
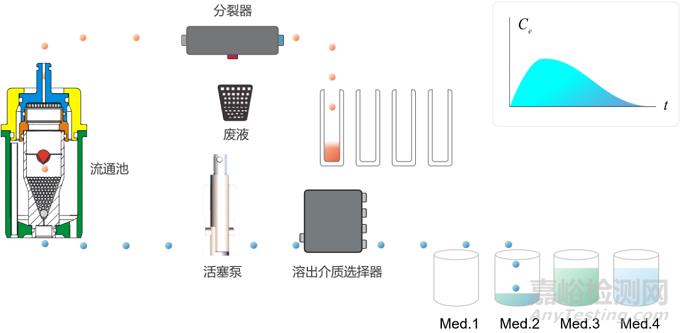
图3 开放式流通池系统示意图
体内外相关性表示制剂体外特征(如药物释放曲线)与其体内性能(如血药浓度-时间曲线)之间的数学关系,目的是使用体外溶出数据预测药物的体内血药浓度-时间曲线。研究者使用经过验证的体内外相关性来获得生物等效豁免,即通过使用溶出试验来替代体内生物等效性试验,从而在产品开发和药品整个生命周期中节省时间和成本,具有重要意义。流池法不仅可以实现介质pH种类、用量及流速的调节,从而模拟人体消化道的pH环境及消化液体积的变化,还可以在池底放置玻璃珠,以此来改变介质流动方式,模拟有无食物状态及不同年龄、不同病理条件下患者的胃肠蠕动情况,从而更准确地反映药物在体内的转运过程及药物的作用特点,适用于体内外相关性研究。
03流池法在新型递药系统中的应用
微球
Zolnik等人比较流池法及传统溶出方法测定地塞米松微球溶出度的差异,研究发现流池法大大减少了聚合微球的损失[1]。
梁苑英竹等人分别采用转瓶法及流池法研究注射用醋酸奥曲肽微球体内外释放度[2]。图2为样品体内-体外加速释放相关性结果。研究表明采用流池法测定的体外加速释放快于转瓶法,且与体内释放具有良好的相关性(R>0.96),为评价奥曲肽微球的体内外释放提供了参考。
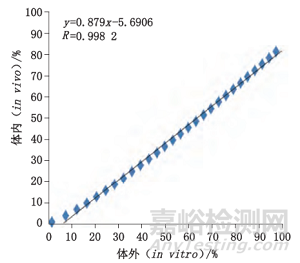
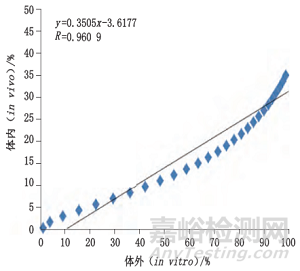
图2 流池法测定的样品A和B体内-体外加速释放相关性
渗透泵片
渗透泵片是由药物、半透膜材料、渗透压活性物质和推动剂等组成,以渗透压作为释药能源的控释片,其基本结构是先将药物与适宜辅料压制成片芯,外包一层半透性物质膜,后用激光在膜上打一小孔。胃肠道水分透过半透膜进入片芯使药物溶解,产生渗透压,可透过半透膜使水分源源不断地进入片芯。由于半透膜内容积的限制,药物的近饱和浓度溶液又不断地通过激光孔移向片外,这样就使药物以恒定的速率释放到片外,因此称为渗透泵。
Emara等利用流池法研究双氯芬酸钠渗透泵片的体外释放行为,结果可以区分出不同辅料制备的渗透泵的释放速率上的差异,表明流池法可以从释放度这一关键质量属性为处方筛选提供新的研究思路[3]。
脂质纳米粒
脂质纳米粒是以具有生物相容性的脂质材料为载体,将活性药物溶解或包裹于脂质核或吸附于纳米粒子表面的新型载药系统。脂质纳米粒具有改善药物吸收、改变药物体内吸收过程、提高稳定性、增效减毒等优势,同时在生物体内或贮存过程中均稳定,现已广泛应用于基因药物、抗癌药及多肽药物等。脂质纳米粒根据结构及载药机制的不同可分为固体脂质纳米粒、纳米结构脂质载体。脂质-药物共轭物、合物脂质杂化纳米粒等。
Desmond Heng等人采用桨法、篮法及流池法测定并比较头孢呋辛酯纳米粒的溶出速率[4]。结果显示通过流池法、篮法和桨法三种方法测定的纳米粒与未加工的纳米粒子的溶出比率分别为6.95、1.57和1.00,而模型预测值为7.97。以上数据表明流池法能够反映药物的真实溶出程度,是测定纳米粒溶出特性的最适宜方法。
此外,Lucas等发现相比于篮法,流池法可以更好的测定载药纳米粒的溶出速率和溶解程度[5]。
04展 望
现代评价药物释放度的方法越来越向着模拟人体内环境的方向发展,具有较高体内体外相关性的方法成为人们选择测定药物释放度的一个重要选择。流池法作为一种新型的溶出度测定方法,顺应了这一发展趋势,在适用范围及适用性等方面极大地弥补了传统释放度方法的不足,在制剂处方设计研究和质量控制方面具备十分广阔的应用前景。
参考文献
[1] ZOLNIK B S 等. Application of USP apparatus 4 and in situ fiber optic analysis to microsphere release testing.
[2] 梁苑英竹等. 注射用醋酸奥曲肽微球体内外释放度分析.
[3] EMARA.Development of an osmotic pump system for controlled delivery of diclofenac sodium.
[4] What is a suitable dissolution method for drug nanoparticles?
[5] Lucas Sievens-Figueroa. Using USP I and USP IV for discriminating dissolution rates of nano- and microparticle-loaded pharmaceutical strip-films.

来源:药事纵横


