您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-06-01 12:29
自2023年5月23日起,澳大利亚TGA将取消通过ISO13485证书申请IVD产品的通道。
二类及二类以上产品必须有CE证书才能申请TGA,需要注册澳大利亚TGA的制造商需要还请尽快。
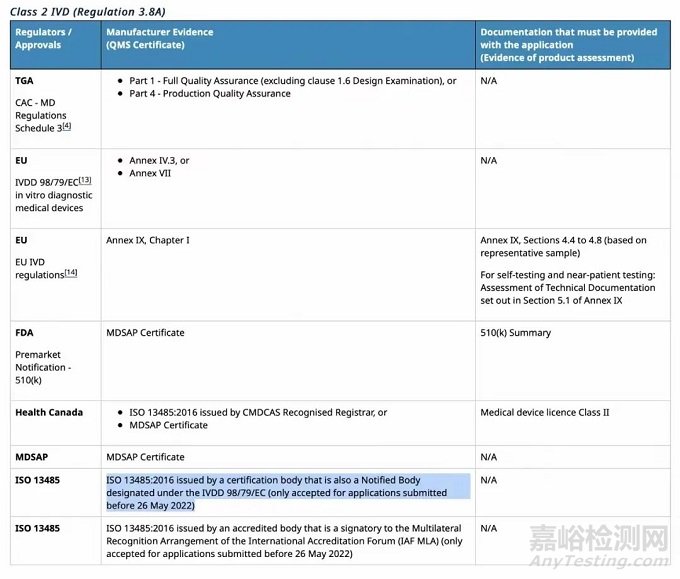
TGA申请所需资料清单
1 ISO13485体系证书
2 准确性报告
3 非医用可用性临床确认报告
4 用戶說明書 (英文)
5 包裝設計
6 產品穩定性測試報告(運輸,存放)
TGA申请流程
1. Sponser向TGA提交制造商QMS资质
2. TGA审核QMS资质
3. Sponsor向TGA提交器械注册申请
4. TGA接受/驳回申请
5. TGA发出申请所需资料清单
6. Sponsor 提供清单列出的证据
7. TGA反馈证据审核意见
8. 补充缺失资料
9.资料完整后发证

来源:鸿盟标准


