您当前的位置:检测资讯 > 热点事件
嘉峪检测网 2022-10-06 02:26
近日,FDA宣布,我们现在可以通过CDRH Customer Collaboration Portal (“CDRH Portal”),以 eCopy或eSTAR方式,线上发送上市前递交文档。目前这种递交方式适用于三种类型的510(k)。
医疗器械制造商可以通过CDRH Portal继续追踪510(k)的进度,CDRH打算在2023年将这个追踪方式拓展到其他递交类型(如,PMA,De Novo,预递交等),并添加其他功能。
FDA目前计划如下图所示。
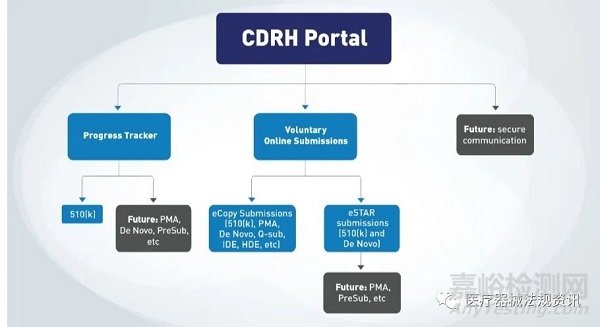
【背景信息】
FDA在2021年就启动了510(k)递交进度追踪器,电子上传的试行在2022年7月启动,当时只允许递交了510(k)的官方联络人通过此方式试行,现在CDRH Portal 允许任何人通过注册一个CDRH Portal的账号来线上发送CDRH eCopy或eSTAR。
关于510(k)递交进度追踪器的相关内容,请见如下文章:
你可以追踪510k审核进度了
从2023年10月1日起,所有510(k) 递交,必须使用eSTAR递交510(k)文档,除非豁免。
关于eSTAR递交的相关内容,请见如下文章:
定了!FDA 510(k)递交方式一年之后将强制过渡到eSTAR

来源:医疗器械法规资讯


