您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-13 06:22
我们一起来学习化学表征的原理、应用和流程吧~
专家提示
获取化学信息的过程,这个过程可以通过文献综述收集信息或者通过化学实验生成需要的信息。新定义增加了收集信息的内容,与ISO 10993-1:2018优先收集物理/化学信息进行生物安全性评价的宗旨相契合,意味着通过收集全面的信息可以证实材料或器械等同性的情况下,不再需要进行化学实验或者生物试验。
1 化学表征的原理及应用
一般来说,生物相容性信息可以从化学表征结果的相关毒理学数据,以及生物测试两种评估中获得。风险评估应包括化学和生物数据的适当组合,但体外试验应尽可能优先[7]。
生物安全评估可分为两类:系统全身效应类型(即取决于可浸提物或沥滤物的系统分布的类型)和局部效应类型(即发生在医疗器械附近的效应类型)。与局部效应(如刺激和植入局部效应)相比,评价全身效应或终点(如全身毒性)的试验,更有可能通过化学表征得到阐明和实现,即通过合理的化学表征,可以豁免致癌毒性、基因毒性、全身性毒性(如急性毒性、亚急性毒性、慢性和亚慢性毒性等)和生殖发育毒性等动物试验。对于细胞毒性、皮肤刺激、致敏以及血液相容性、植入实验中对组织的局部影响部分,则可能需要额外的测试来支持生物相容性终点的评价。
化学表征可以通过以下方式促进生物安全性评估过程:
1、提供所述医疗器械与临床使用器械之间能够进行比较的化学信息,从而建立等同性
2、提供所述医疗器械与相关材料标准进行比较的化学基础,以确认其符合性
3、提供作为毒理学风险评估基础的化学信息,从而启动风险评估
2 化学表征的流程
化学表征是医疗器械/组件生物风险评估的一部分。根据新版ISO 10993-1:2018的标准要求,先要全面收集产品有关的所有物理/化学信息,根据信息进行生物风险评估。
资料信息包括但不限于
材料的牌号
成分组成
加工工艺
使用的加工助剂和添加剂
与患者的接触方式、时间、性质
使用历史
文献收录
……
信息资料越多越全,风险评估越容易,可能需要的额外测试越少。如果信息评估结果不能证明产品的生物等同性,则需要进行化学表征测试或/和生物相容性测试,再结合表征和测试结果形成一份完整的风险评估报告。
专家提示
医疗器械由各种材料组成,化学表征测试的三个步骤:
1、需要确定材料的结构和表面形态,证明材料的物理等同
2、需要研究可浸提物谱和沥滤物谱,证明材料的化学等同
3、结合动物试验考察的生物终点等同
物理等同和化学等同共同证实了材料等同。再结合生物终点等同,就最终完成了生物等同性的评估。
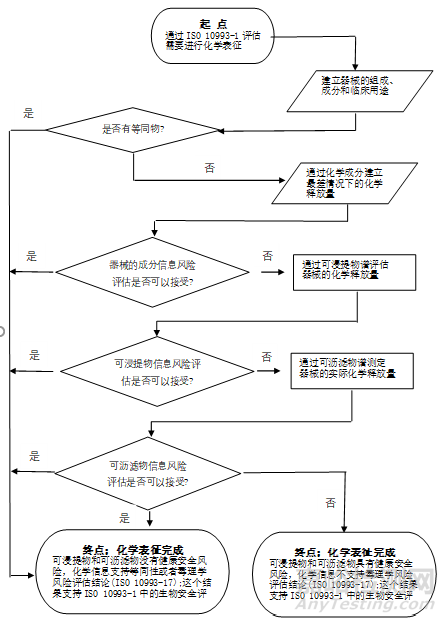
新版标准根据最新的定义,更新和扩展了化学表征的总流程图,并将流程图由附录A调整到正文中。同时,增加了材料成分谱研究流程图、可浸提物谱研究流程图、沥滤物谱研究流程图,使整个研究流程更具体、科学、顺畅,并且可操作性更强。
化学表征总体流程图 (摘自ISO 10993-18:2020 )
通过今天的学习,大家对化学表征已经了解了不少,明天我们将共同探讨化学表征的环节和方法。
参考文献
[7] ISO 10993-2:2006 医疗器械生物学评估—第2部分:动物福利要求.2006.

来源:Internet


