您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-11-17 10:39
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.全球首个IgA肾病靶向药在华报产。云顶新耀从Calliditas公司引进的布地奈德的创新口服靶向迟释制剂Nefecon的上市申请获CDE受理,用于治疗原发性IgA肾病(IgAN)。在关键Ⅲ期NefIgArd试验A部分中,Nefecon治疗9个月后患者的尿蛋白肌酐比(UPCR)较安慰剂组降低27% (P=0.0003) ,Nefecon组和安慰剂组的UPCR较基线值分别减少31%和5%。该新药已在美国和欧盟获批上市,是全球首个IgA肾病的靶向治疗药物。
2.恒瑞JAK1抑制剂自免皮炎III期临床成功。恒瑞旗下瑞石生物艾玛昔替尼片(SHR0302)治疗特应性皮炎的国际III期临床RSJ10333(QUARTZ 3)达到共同主要终点及所有关键次要终点。与安慰剂相比,SHR0302治疗组16周时达到IGA 0/1应答及EASI 75应答的比例显著更高;该药最快可两天起效,在1周-16周期间,8mg和4mg剂量组最严重瘙痒数字评分改善≥4分的患者比例均显著高于安慰剂组(P值均<0.001)。SHR0302有望成为用于自免适应症的首个获批的国产JAK1抑制剂。
3.科伦博泰TROP2-ADC获FDA批准II期临床。科伦博泰TROP2-ADC药物SKB264(MK-2870)获FDA临床许可,拟开展II期临床,评估联合默沙东PD-1帕博利珠单抗用于治疗晚期实体瘤的有效性与安全性。今年7月,这一组合疗法已获NMPA临床批件。该公司计划在中国、美国、加拿大、欧洲和澳洲等国开展这项国际临床研究。默沙东今年8月已获得该新药在中国以外区域开发、生产和商业化授权。
4.康方TIGIT/TGF-β双抗获批临床。康方生物1类生物制品AK130注射液获国家药监局临床试验默示许可,拟开发用于晚期恶性肿瘤的治疗。AK130是一款TIGIT/TGF-β双功能融合蛋白。通过独特的双靶点4价设计,AK130可高亲和力、特异性地结合TIGIT和TGF-β,双重解除免疫抑制,激活抗肿瘤免疫反应;还可抑制肿瘤,实现更高的肿瘤组织存留,提高疗效和安全性。全球范围内,尚无TIGIT/TGFβ双抗获批。
5.先声引进双食欲素受体靶向失眠新药。先声药业与瑞士Idorsia公司就后者新型抗失眠药物daridorexant签订独家许可协议。Daridorexant是一款双食欲素受体拮抗剂,已在美国获批上市,商品名为QUVIVIQ。根据协议,先声药业将获得daridorexant在大中华地区(中国大陆、香港、澳门)开发和商业化的独家权利。Idorsia公司将获得3000万美元的首付款,和2000万美元额外里程碑付款,以及产品的销售分成。
国际药讯
1.优时比重症肌无力创新药在欧美报产。优时比新型大环肽类C5补体抑制剂zilucoplan的上市申请分别获得FDA与欧洲EMA受理,用于治疗乙酰胆碱受体抗体阳性(AChR-Ab+)、全身性重症肌无力的成年患者。Zilucoplan具有抑制末端补体途径激活和MAC下游组装的双重作用机制。在关键Ⅲ期RAISE研究,zilucoplan治疗组患者的安慰剂矫正的重症肌无力-日常生活活动能力量表(MG-ADL)总分平均改善2.09分(p<0.001),而且zilucoplan的耐受性良好。
2.第一三共新冠mRNA疫苗III期研究成功。第一三共开发的新冠mRNA疫苗DS-5670用于加强针接种的I/II/III期试验达到主要终点。5000名日本健康成人和老年人在两针mRNA疫苗(辉瑞和Moderna)后加强接种DS-5670,受试者4周后血液中抗SARS-CoV-2(原始毒株)中和抗体滴度升高倍数(GMFR)较已获批的mRNA疫苗更高,达到非劣性标准。详细结果将在学术会议上发表。第一三共计划明年初递交DS-5670的上市申请。
3.外用PED4抑制剂自免皮炎Ⅲ期临床成功。Arcutis公司下一代PDE4抑制剂roflumilast乳膏用于治疗轻、中度特应性皮炎的Ⅲ期临床(INTEGUMENT-1)达到主要终点和所有次要终点。与溶剂对照组相比,0.15% roflumilast组患者达到IGA 缓解(皮炎症状被清除,或是几乎清除,并与基线相较有2级的改善。)的比例更高(32.0%vs15.2%,P<0.0001)。药物总体耐受性良好。FDA此前已批准roflumilast(0.3%)的乳剂制剂Zoryve上市,用于12岁以上斑块状银屑病患者。
4.儿童PGHD口服药II期临床成功。Lumos公司生长激素促分泌素受体(GHSR)激动剂LUM-201治疗生长激素缺乏症(PGHD)的两项II期研究(OraGrowtH210和OraGrowtH212)中期分析结果积极。OraGrowtH210研究6个月的治疗数据显示,LUM-201(1.6mg/kg/天)组患者的年化身高增长速度(AHV)符合预期(8.3厘米/年)。OraGrowtH212研究结果显示,治疗6个月后,两个剂量组患者的AHV与OraGrowtH210研究的数据相当。药物的安全性与重组人生长激素相当。
5.DHE鼻喷剂急性偏头痛III期临床失败。Satsuma公司双氢麦角胺(DHE)鼻腔喷雾剂STS101治疗急性偏头痛的III期SUMMIT试验未达到共同主要终点。与安慰剂相比,STS101给药2小时后实现无疼痛和最麻烦的症状包括恐光、恐声和恶心(MBS-free)受试者比例上存在数值差异,但不具有统计学意义(p值<0.05)。但STS101在给药后3小时以及随后评估疗效的所有时间点在无疼痛和MBS-free终点的疗效方面较安慰剂有显著差异。该公司拟按照计划明年向FDA申报NDA。
6.罗氏与Jnana公司达成超20亿美元合作。罗氏与Jnana Therapeutics达成第二项合作和许可协议,将利用后者专有RAPID化学蛋白质组学平台,针对癌症、免疫介导和神经系统疾病中多种靶标类别开发新型小分子药物。根据协议,Jnana将获得5000万美元的前期、重大的近期里程碑付款,以及超过20亿美元的后期里程碑付款。罗氏将负责所有候选药物的开发和商业化。Jnana Therapeutics同时也完成由贝恩资本生命科学基金领投的1.07亿美元的C轮融资。
医药热点
1.高血压诊断标准未调整。11月15日,国家卫健委发布消息明确,关于高血压诊断标准,2005年、2010年、2017年国家卫生行政部门发布的宣传教育要点、防治指南、临床路径等均明确:成人高血压的诊断标准为非同日3次血压超过140/90毫米汞柱。目前,国家未对成人高血压诊断标准进行调整。由专业机构、行业学协会、个人等自行发布的指南、共识等,为专家的研究成果,不作为国家疾病诊断标准。
2.70名生物医学专家入选2022年“高被引科学家”榜单。11月15日,科睿唯安发布了2022年“高被引科学家”名单。来自全球69个国家和地区的6938人入选高被引科学家名单。位列前三的国家(地区)分别是:美国2764人次,中国内地1169人次,英国579人次。中国内地位列前三的机构分别是:中国科学院228人次,清华大学73人次,湖南大学32人;其中,生物医学领域方面,有70名专家入选。
3.日本单日新增新冠确诊病例再超10万。日本厚生劳动省15日发布的数据显示,截至当天零时,日本24小时内新增新冠确诊病例102829例,自9月14日以来时隔两个月单日新增病例再超10万。东京都当天报告新增病例11196例,同样为9月14日以来再次超过1万例,新增死亡病例7例。另外,北海道当天报告新增病例也超过1万例,再次刷新疫情以来单日新增病例数最高纪录。
评审动态
2. FDA新药获批情况(北美11月14日)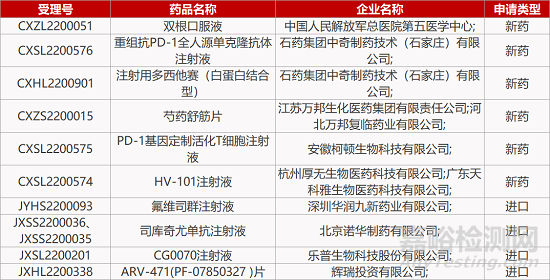


来源:药研发


