解离常数(dissociation constant)是水溶液中具有一定解离度的溶质的极性参数。绝大多数的药物包含可电离的基团,多数为碱性的,也有部分为酸性。只有极少部分为中性,不能电离。pKa是电离常数Ka的负对数。对于酸和碱,通常均采用pKa表示。
对于酸:
HA = H+ + A-
pKa =-log([H+][ A-]/[HA])
对于碱:
HB+ = H+ + B
pKa =-log([H+][ B]/[HB+])
pKa表明了一种化合物的电离度,它是分子中基团与酸性、碱性的关系函数。药物化学家可以改变分子中酸性或碱性的结构,以便得到期望的pKa,而pKa可以影响药物的溶解性和渗透性。在之前的文章中也提到,pKa是影响化合物是否能够和酸或者碱成盐的关键。一般认为,当两种组分的ΔpKa> 3时,形成盐;而0 < ΔpKa <3是可能形成共晶,也可能形成盐,没有明确的界限。在进行临床前制剂开发时,化合物的pKa也是是否可以使用调节pH方式增溶的依据。影响pKa大小的因素主要有以下几个。
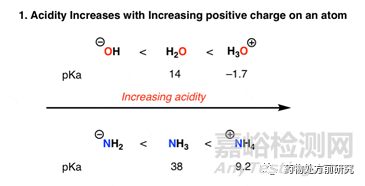
1. 电荷(charge)
从pKa的定义可知,pKa反映的是分子脱去质子(H+)的能力。分子越是容易脱去质子,则其酸性就越强,pKa也就越小;相反,分子越是难脱去质子,则其酸性越弱,pKa也就越大。因此,如果分子上离开一个质子,则其形式电荷(formal charge)就降低一个单位。此时,再失去一个质子就变得困难一些。如下图所示,当水分子得到一个质子变成H3O+,它的质子容易脱去,所以pKa相比H2O变小。而如果脱去一个质子,变为羟基(OH-),则很难继续脱去质子。
2. 原子的作用
从元素周期表,横向比较,电负性越大,则酸性越强。已知C、N、O、F中F的电负性是最大的,所以HF的pKa是最小的。而纵向比较,原子的半径越大,则酸性越强。已知F、Cl、Br、I中I的原子半径是最大的,所以HI的pKa是最小的。同样,S的原子半径大于O,所以H2S的pKa小于H2O。元素的电负性越大,表示其原子在化合物中吸引电子的能力越强。也就是说,电负性越大,越容易得到电子,形成负离子;电负性越小,越容易失去电子,形成正离子。形成负离子也就是和H+的作用变弱,所以容易脱去质子。而随着原子半径的增大,负离子对H+的吸引力下降,所以容易脱去H+,酸性增强。

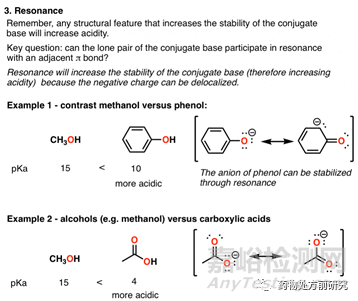
3. 共振(Resonance)
共振(共轭)对化合物的酸性有很大影响,一个典型的例子就是苯酚和水,苯酚的酸性是水的数百万倍。如下图所示,甲醇和苯酚虽然都有一个羟基,甲醇的羟基连着甲基,而苯酚的羟基连着苯基。甲醇的酸性是比较弱的,而因为苯环可以形成共轭结构,O上的电子可以跑到苯环上,所以酚羟基中的质子更容易离去。因此,苯酚的酸性要强于甲醇。而甲醇和乙酸也是类似的情况,乙酸中的-OH的质子可以更容易离去,所以酸性更强。诱导效应非常重要,在药物分子碱性位点的判断中常常起到关键作用。
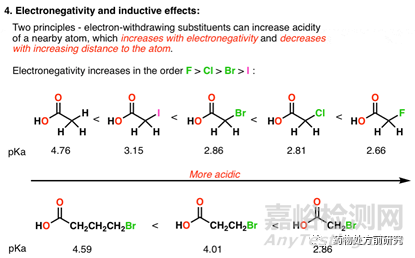
4. 诱导效应(Inductive effects)
电负性的原子可以吸引负电荷,从而使得共轭碱更稳定。已知电负性大小顺序为F﹥Cl﹥Br﹥I,所以F吸电子作用最强,F取代的酸酸性最强。如下图所示,乙酸的酸性是最弱的,而当甲基中的H被卤原子取代后,F代乙酸酸性是最强的,而I代乙酸酸性是最弱的,但强于乙酸。很容易理解,如果电负性原子和H的距离越远,则对其影响越小。
5. 轨道(Orbitals)
电子轨道对酸性也有影响。如下图所示,如果s特性越高,则酸性越强。sp3杂化s特性的比例是25%,sp2杂化s特性的比例是33%,sp杂化s特性的比例是50%。也就是说sp杂化的分子酸性最强。
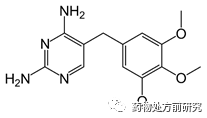
对于药物分子而言,绝大多数化合物都是游离碱或者游离酸。游离酸的情况比较简单,因为游离酸大多数都是羧酸,而羧酸的pKa基本在4左右。所以在对化合物pKa进行判断时要注意上面的这些影响因素,特别是共轭效应。下图所示的是甲氧苄啶的化学结构式。从结构式看有两个氨基,氨基是很强的碱。但两个氨基连在嘧啶环上,所以会形成共轭,所以此时碱性位点不是氨基,而是嘧啶环上的N。甲氧苄啶可以和很多酸形成盐,通过盐的单晶结果可以知道是哪个位点成盐。通过检索CCDC晶体结构库,发现成盐位点确实是嘧啶环上的N。