摘要
自上世纪90年代起,监管机构陆续发布相关指南,推动对药物及医疗器械与包装材料的相容性的研究,相关法规亦在二十来年中逐步建立完善,本问梳理国际国内监管机构对医疗器械包材相容性的监管法规,结合实验室经典案例深入解析,旨在进一步明确医疗器械包材研究内容。
一、研究背景
上世纪八九十年代,美国FDA在监管中陆续检测到强致癌物多环芳香烃(PAHs)、致癌物亚硝胺类化合物和致敏物2-巯基苯并噻唑(2-MBT),开始重视相关可提取物的报告,业界自此逐渐关注对药物包装材料中金属元素含量的考察。
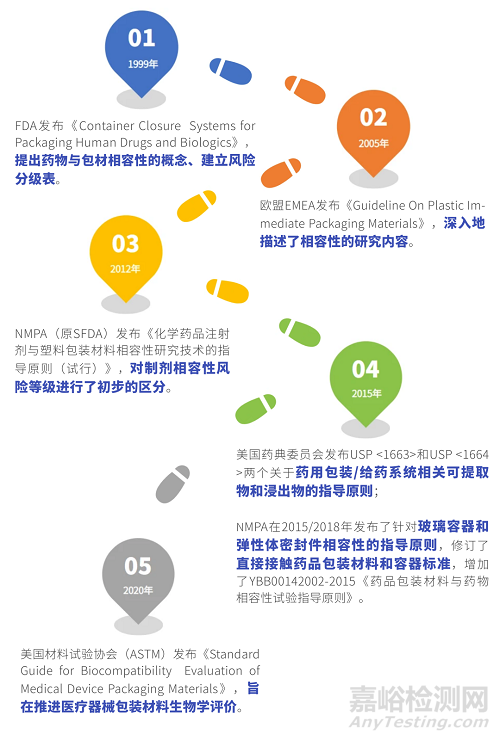
1999年,FDA发布《Container Closure Systems for Packaging Human Drugs and Biologics》,提出了药物与包材相容性的概念,根据不同给药途径制剂与包装系统发生相互作用的可能性建立了风险分级表(表格详情见下文)。在此时期,药物与包材相容性研究正式起步。
包装系统起初来源于药品领域,其研究内容主要针对直接接触药品的包装系统进行阐述。包装系统一方面为药品提供保护,以满足其预期的安全有效性用途;另一方面还应与药品具有良好的相容性,即不能引入可致安全性风险的浸出物,或引入浸出物的水平符合安全性要求。
standard guide for biocompatibility evaluation ofmedical device packaging materials
医疗器械包材(生物)相容性的定义来源于ASTM F2475(国内转化标准:T/CAMDI 033-2022《医疗器械包装材料的生物学评价指南(征求意见稿)》),是指材料防止所包装医疗器械在预期应用中对宿主产生不良反应的化学变化的固有能力。
三、医疗器械包材相容性相关法规发展
3.1 国际方面
1999年,FDA发布《Container Closure Systems for Packaging Human Drugs and Biologics》,提出了药物与包材相容性的概念,并建立制剂相容性风险分级表(见表1)。此表后来也被其他国家的法规(包括我国NMPA发布的三项指导原则)陆续引用,一直沿用至今,具有深远的影响。
表1 制剂相容性风险等级
——《Container Closure Systems for Packaging Human Drugs and Biologics》/《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》
2005年,欧盟EMEA发布《Guideline On Plastic Immediate Packaging Materials》,深入地描述了相容性的研究内容——提取研究和相互作用研究的原则。
2015年,美国药典委员会分别发布USP <1663>和USP <1664>两个关于药用包装/给药系统相关可提取物和浸出物的指导原则。2020年,美国材料试验协会(ASTM)发布《Standard Guide for Biocompatibility Evaluation of Medical Device Packaging Materials》,旨在推进医疗器械包装材料生物学评价。
3.2 国内方面
2012年,我国NMPA(原CFDA)发布了第一项关于包材相容性的指导原则——《化学药品注射剂与塑料包装材料相容性研究技术的指导原则(试行)》,并对制剂相容性风险等级进行了初步的区分(见表1)。
随着研究水平飞速增长和监管力度的不断加强,NMPA分别在2015年和2018年发布了针对玻璃容器和弹性体密封件相容性的指导原则,并在2015年修订了直接接触药品包装材料和容器标准,增加了YBB00142002-2015《药品包装材料与药物相容性试验指导原则》。这些法规的发布有效地帮助国内研究者们明确了方向,开拓了思路。
整体来看,为鼓励企业开展科学有效的包装材料相容性研究,各方监管机构都陆续发布了相关指南,旨在推进医疗器械包装材料生物学评价。在实用过程中配合好就可以实现优势互补,更高效地指导研究内容,为产品申报及质量控制提供科学全面的资料。
四、医疗器械包装材料及其审评关注点
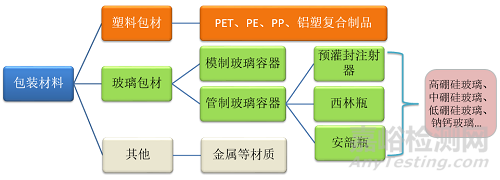
医疗器械包装材料与药包材基本一样,根据材质的不同,通常可分为塑料包材、玻璃包材等。
根据材质的不同,在相容性评估过程中的审评关注点也是不同的:
玻璃
重点考察玻璃中碱性离子的释放对器械pH的影响、有害金属元素的释放、玻璃的脱片的微观形貌及重点元素含量、塑料对医疗器械的吸附等作用、胶塞中的特殊化合物等问题。
塑料
重点考察医疗器械酯溶性成分导致塑料中的添加剂加工助剂向医疗器械的转移;塑料中添加剂、加工时分解产物对医疗器械的影响;塑料对医疗器械的吸附等作用。
其它材质
结合产品的材料、工艺过程等,考虑可能存在的风险并评估。
五、医疗器械包材相容性试验指南
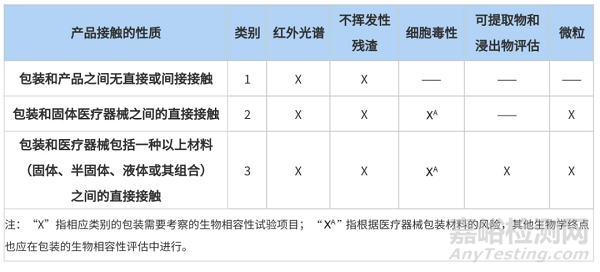
医疗器械包材相容性时需要考虑哪些内容呢?根据接触情况的不同,ASTM F2475-20中给出了答案。该指南中将器械与包装材料的接触情况进行了分类,不同接触情况推荐开展不同程度的研究内容,详情如下表:
表2 生物相容性试验指南
六、小结
本文简单梳理了医疗器械包材相容性研究的历史来源、法规及相关指导原则,通过对相容性研究发展历程的回顾,提示药械伙伴及时跟进相关的研究进展,特别是随着业界对浸出物毒性认识的不断深入,相容性评估标准及安全阈值相关要求/标准也在不断的更新。
在开展相容性研究时,药械企业需要根据不同的接触情况评估需要开展的研究内容。值得注意的是,包装与非固体(如凝胶状、膏状、溶液)医疗器械产生直接接触时,应结合材质及器械的风险,重点考虑可提取物与浸出物研究。建议药械企业在研发阶段就先行布局,选择合适的包材,更有利于产品申报和后续产品质量的控制。
【参考文献】
[1] Container Closure Systems for Packaging Human Drugs and Biologics
[2] Guideline On Plastic Immediate Packaging Materials
[3] 《化学药品注射剂与塑料包装材料相容性研究技术的指导原则(试行)》
[4] YBB00142002-2015《药品包装材料与药物相容性试验指导原则》
[5] USP <1663> Assessment of extractables associated with pharmaceutical packaging/delivery system.
[6] USP <1664> Assessment of drug product leachables associated with pharmaceutical packaging/delivery system
[7] ASTM F2475-20, Standard guide for biocompatibility evaluation of medical device packaging materials
[8] 《化学药品注射剂与塑料包装材料相容性研究技术的指导原则(试行)》
[9] 《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》
[10] 《化学药品与弹性体密封件相容性研究技术指导原则(试行)》
[11] 《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(试行)》
[12] T/CAMDI 033-2022《医疗器械包装材料的生物学评价指南年(征求意见稿)》