今日头条
艾欣达伟小分子偶联新药获批临床。深圳艾欣达伟医药基于“乏氧活化”前药的技术平台自主开发的小分子偶联新药AST-006获国家药监局临床许可,拟开发用于BRCA1/2突变恶性肿瘤的治疗。AST-006能够在缺氧区域被激活,产生活性代谢产物Br-IPM,导致肿瘤细胞死亡。在多项临床前研究中,AST-006具有良好的安全性以及广谱的抗肿瘤活性,预期为BRCA1/2突变恶性肿瘤,特别是对PARP抑制剂耐药的肿瘤患者提供新的治疗选择。
国内药讯
1.誉衡PD-1单抗获批宫颈癌适应症。誉衡生物PD-1抑制剂赛帕利单抗(GLS-010,商品名为誉妥)获国家药监局批准新适应症,用于接受过一线或以上含铂标准化疗后进展的复发或转移、PD-L1表达阳性(CPS≥1)的宫颈癌。GLS-010通过阻断PD-1信号通路来激发人体自身的免疫系统,清除患者体内的癌细胞,从而实现抗肿瘤作用。2021年8月,该产品在中国获批首个适应症,用于治疗二线以上复发或难治性经典型霍奇金淋巴瘤。
2.上海丹瑞细胞免疫疗法上Ⅲ期临床。上海丹瑞生物细胞免疫疗法Sipuleucel-T注射液(Provenge)在治疗转移性去势抵抗性前列腺癌(mCRPC)的中国III期临床完成首例患者回输。Provenge是全球首款实体瘤领域的细胞免疫疗法,主要成分是经过PA2024抗原体外激活的来源于患者自体的免疫细胞,已于2010年获FDA批准上市,用于治疗mCRPC。Real-world研究数据显示,在Zytiga®或Xtandi®中添加Provenge,mCRPC患者的死亡风险将降低45%,总生存期延长14.5个月。
3.康方IL-12/23单抗UC早期临床积极。康方生物在FOCIS 2023年会上公布其IL-12/23p40单克隆抗体依若奇单抗(AK101)治疗中重度活动性溃疡性结肠炎(UC)的Ⅰ期临床积极结果。8周治疗数据显示,AK101可提高改良Mayo评分(患者活动期严重程度的评判标准)和Mayo评分的临床应答率,以及改善患者的排便次数和便血症状。治疗期间不良事件(TEAE)多为轻中度。此前,该产品治疗中重度银屑病的Ⅲ期临床已达到主要研究终点。
4.创胜Claudin18.2抗体胃癌早期临床积极。创胜集团在ESMO2023年会上公布Claudin18.2单抗Osemitamab (TST001) 联合卡培他滨和奥沙利铂(CAPOX)一线治疗CLDN18.2表达水平的晚期胃/胃食管连接部(G/GEJ)癌的I/II期临床(NCT04495296)扩展研究C队列积极结果。中位随访为195天时,Osemitamab(6mg/kg)治疗达到66.7%的部分缓解。预计中位无进展生存期(PFS)为9.5个月。无进展生存期与CLDN18.2表达水平无明显相关性。Osemitamab的安全性主要表现为可控的非特异性靶向副作用。
5.璎黎泛KRAS突变抑制剂获批临床。璎黎药业自主研发的泛KRAS突变小分子抑制剂YL-17231获FDA批准在美国开展I期临床研究。在临床前研究中,与现有KRAS抑制剂相比,YL-17231对于更多的KRAS突变类型具有更强的抑制作用,广泛适用于携带KRAS G12C、G12D、G12V、G13D、G12R、G12A等突变,以及KRAS野生型扩增的癌症和对KRAS G12C抑制剂(如sotorasib和adagrasib)产生耐药性的癌症。此前,国内外尚未有这类抑制剂药物进入临床。
6.湖南九天眼内注射基因疗法美国获批临床。九天生物AAV眼科基因治疗药物SKG0106获FDA批准,即将开展全球I/IIa期临床,评估用于新生血管性年龄相关性黄斑变性(nAMD)的安全性与有效性。SKG0106携带编码独特的抗VEGF蛋白的转基因序列,通过单次玻璃体腔注射后在眼内高效转导视网膜细胞表达抗VEGF蛋白,以抑制VEGF生物活性并阻断眼内新生血管增生。去年年底,该新药已在国内获批临床。
7.复诺健新一代溶瘤病毒获批临床。复诺健非减毒骨架的溶瘤病毒产品VG203获FDA批准开展Ⅰ期临床试验,评估用于治疗晚期实体瘤患者的安全性与有效性。VG203使用CXCR4作为肿瘤特异性启动子,并在临床前实验中表现出生物标记物CXCR4与病毒复制的良好相关性。该项试验将同时关注有望取得更好疗效的CXCR4阳性肿瘤,分析CXCR4表达水平与疗效的关系,积极探索后期开展基于生物标记物指导的临床试验(篮式设计)的可能性。
8.信达EGFR/B7-H3双抗报IND。信达生物1类生物制品IBI334的临床试验申请获CDE受理。IBI334是一款EGFR/B7H3双抗,已于今年3月在Clinicaltrials.gov网站上登记注册了一项Ⅰ期临床试验,计划入组128例晚期实体瘤患者,评估IBI334用于治疗晚期实体瘤的安全性、耐受性和药代动力学特征,以及初步疗效。该项试验预计从今年7月份启动,2025年10月初步完成。据悉,信达生物已有10款双抗新药进入临床阶段。
国际药讯
1.阿斯利康TROP2 ADC肺癌III期临床积极。阿斯利康与第一三共开发的TROP2-ADC药物Dato-DXd(datopotamab deruxtecan)用于治疗局部晚期或转移性非小细胞肺癌(NSCLC)经治患者的III期TROPION-lung 01研究获积极结果。数据显示,该研究达到无进展生存期(PFS)主要终点,总生存期(OS)主要终点还未成熟,但在中期分析中已观察到有利于Dato-DXd的趋势;安全性数据与已知研究一致,没有观察到新的安全信号。
2.RASP调节剂止咳Ⅱ期临床积极。Aldeyra公司新型口服活性醛类物质(RASP)调节剂ADX-629治疗慢性咳嗽患者的Ⅱ期临床结果积极。与安慰剂组相比,ADX-629治疗组的清醒时咳嗽频率显著降低(P=0.01),24小时咳嗽频率(P=0.001)、清醒咳嗽计数(P=0.001)和24小时咳嗽计数(P=0.001)均达到统计学上的显著性。ADX-629耐受性良好,没有发现安全性问题。
3.皮质类固醇创新制剂膝关节疼痛临床积极。Eupraxia公司开发的无需冷藏、基于皮质类固醇的膝部注射制剂EP-104IAR在治疗膝骨关节炎相关疼痛的Ⅱb期临床达到主要终点。与安慰剂相比,EP-104IAR治疗12周时患者WOMAC疼痛评分具有统计学意义(p=0.004)的改善;WOMAC功能评分(p=0.014)、OMERACT-OARSI严格应答者(p=0.011)和WOMAC疼痛的曲线下面积(p<0.001)等三个次要终点也显著改善。EP-104IAR耐受性良好,不良事件与安慰剂类似。
4.长效胰淀素类似物早期数据积极。Zealand公司长效胰淀素类似物ZP8396在用于正常体重和超重受试者的多剂量递增(MAD)试验的第一部分获初步疗效结果。在接受6次0.6mg和1.2mg的ZP8396治疗后,受试者平均体重较基线分别减少5.3%和5.1%,而安慰剂组这一数值仅下降0.4%。ZP8396耐受性良好,没有患者发生严重不良反应。目前该公司正在探索ZP8396更高暴露量的疗效。
5.珐博进CTGF抗体肺纤维化Ⅲ期临床失败。珐博进靶向CTGF的潜在“first-in-class”抗体Pamrevlumab在治疗特发性肺纤维化(IPF)患者III期试验(ZEPHYRUS-1)未能达到主要和次要终点。pamrevlumab治疗组从基线至第48周用力肺活量(FVC)平均降幅(260ml)较安慰剂组(330ml)未达到统计学显著性;疾病进展的次要终点也不具显著性改善。基于此结果,该公司已终止另一项针对IPF的III期试验ZEPHYRUS-2。
医药热点
1.上海知名三甲医院郊区开新院区。 6月25日,上海市胸科医院“心胸疾病临床医学中心”项目开工。该中心位于上海浦东新区唐镇,设置床位600张,总建筑面积近12万平方米。胸科医院浦东新院区不仅将进一步优化上海市以及浦东区域医疗资源布局,也将结合浦东区位优势推进心胸疾病临床医学研究与临床应用进程。
2.复星医药联席首席执行官辞职。7月3日,复星医药发布公告宣布,董事会接到陈玉卿先生的书面辞职函。因工作安排调整,陈玉卿先生向复星医药董事会申请辞去联席首席执行官职务。陈玉卿先生自2023年7月1日起不再担任复星医药联席首席执行官职务。公开资料显示,陈玉卿先生于2010年1月加入复星医药集团,曾任上海复星医药(集团)股份有限公司总裁助理兼人力资源部总经理等职。
3.台湾地区去年新生儿死亡率4.4‰。台湾岛内相关机构2日召开降低新生儿死亡率研讨会。据统计,台湾地区新生儿出生数自2015年后逐年下滑,新生儿死亡率近3年却逐步攀升,去年新生儿死亡率是4.4‰(创15年新高),是日本的2.7倍、韩国的1.6倍,而去年婴儿死亡率,即每千名活产婴儿未满1岁即死亡者,达到2.8‰。新生儿快速死亡与“源于周产期的呼吸性疾患”“与妊娠长短及胎儿生长有关的疾患”“先天性畸形或染色体异常”等三大主因有关。
评审动态
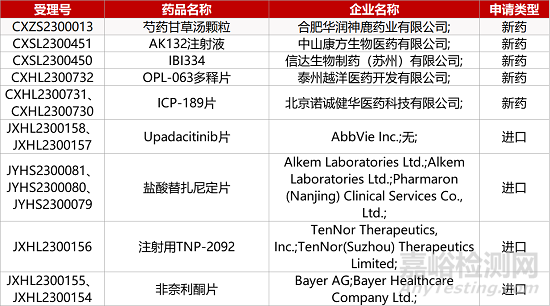
1. CDE新药受理情况(07月04日)
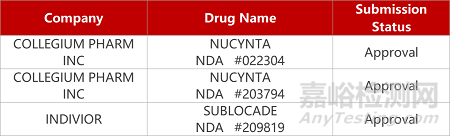
2. FDA新药获批情况(北美07月03日)