医疗器械的可沥滤物是指医疗器械或材料在临床使用过程中释放出的物质的统称。可沥滤物一般包括灭菌残留剂、工艺残留物、降解产物以及材料中的单体及添加剂(包括稳定剂、抗氧化剂、增塑剂、着色剂等)。在医疗器械产品与人体接触并发挥作用的过程中,可沥滤物也在或短期或长期地对人体产生安全性方面的危害。
2、已知可沥滤物安全性评价流程图
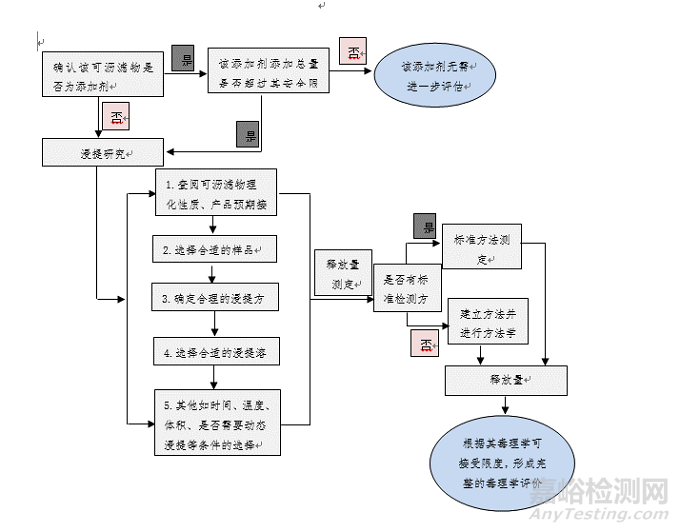
可沥滤物安全性评价首要是确认该已知可沥滤物是否为原材料或最终医疗器械生产过程中添加的添加剂,如抗氧化剂、稳定剂等成分。如果是,应进一步确认该添加剂在原材料或最终医疗器械中的添加总量是否超过该已知可沥滤物的允许限量,如果未超过,则一般无需对该可沥滤物本身的安全性做进一步的研究,如果超过了允许限量,则应模拟临床实际使用最恶劣环境,通过浸提试验研究,获得其最大释放量,并根据其允许限量形成完整的安全性评价报告。
已知可沥滤物测定的一般流程如下:
3、已知可沥滤物试验条件如何确定?
1)浸提方式选择
常用的浸提方式包括模拟浸提、加严浸提、加速浸提和极限浸提(具体可参考GB/T 16886.12部分定义),一般来说模拟浸提最接近于实际,但某些器械采用模拟浸提法可能会要求相对较大的浸提体积,这种情况下,则可能需要极大地提高对可沥滤物测定的灵敏度以满足安全性评价的要求。
浸提液制备过程中,除考虑浸提方式外,还需要充分考虑样品的选择、浸提介质、浸提比例、浸提时间、浸提温度、浸提方式等。但无论选用何种浸提条件,所选浸提条件均不应引起器械材料和目标可沥滤物发生化学变化。
2)样品选择
试验样品优先选择最终产品或取自最终产品中有代表性的样品或经论述的与最终产品相同的工艺过程制得的材料。某些情况下,因产品大型和/或复杂的器械使得无法在终产品上进行浸提时,一般可选取有代表性的部分进行浸提,然后推导出整个器械的结果,代表性的部分可采用如下方法:如果含有几种不同的材料,选取的样品中每一组分占样品的比例宜与该组分占被测器械的比例一致,或选择经评价证明是器械上残留含量最高的一个组成部分进行试验,有时还可以通过相同原材料在相同工艺条件下加工成的最终品检测等方式进行。
3)浸提介质
浸提介质的选择需要考虑以下因素:临床接触介质性质(酸性、碱性、极性、非极性等);已知物的基本性质,如极性、溶解特性等,并结合临床接触介质性质,初步确定拟采用的溶剂;浸提介质的基本性质,如适用时,pH值、极性特征、沸点、可沥滤物在该介质下的溶解度等;替代溶剂的选择,适用时可采用试验证明替代溶剂的提取能力应高于实际临床接触介质。
4)浸提体积
浸提体积的选择首先应保证浸提液能够完全浸没浸提样品,其次浸提液中可沥滤物浓度能够满足检测灵敏度要求,同时还应避免因其浓度过大影响被浸提物质的进一步析出。
5)浸提温度
对于浸提温度,应考虑器械临床实际的使用温度。
6)浸提时间
应按照器械作用于患者的性质和接触时间来确定并尽可能模拟产品临床实际。