今日头条
信诺维TF靶向ADC获批美国临床。信诺维创新抗体偶联药物(ADC)XNW28012获FDA临床许可,拟开发用于治疗实体瘤。在临床前研究中,XNW28012已在组织因子(TF)高表达实体瘤模型中显示出良好的抗肿瘤疗效,而且药物整体安全性可控,有望为TF高表达实体瘤患者提供一种新的治疗方式。今年7月,该新药已在国内获批临床。
国内药讯
1.齐鲁PD-1/CTLA-4组合抗体报产。齐鲁制药1类新药艾帕洛利单抗托沃瑞利单抗注射液(QL1706)的上市申请获CDE受理。QL1706可同时抑制PD-1和CTLA-4,并且CTLA-4抗体成分在体内具有更短的清除半衰期,因此该产品既有同时阻断PD-1和CTLA-4的协同作用机制,又降低了CTLA-4抗体产生的毒性。目前,QL1706联合化疗正在开展多项Ⅲ期临床,适应症包括宫颈癌、非小细胞肺癌和鼻咽癌。
2.礼来口服GLP-1R激动剂启动中国III期临床。礼来开发的口服小分子GLP-1R激动剂Orforglipron(LY3502970)在中国登记启动一项国际III期临床(ATTAIN-1),计划入组280例肥胖或超重伴体重相关合并症中国患者,评估每日一次口服Orforglipron(6mg/12mg/36mg)治疗与安慰剂对比的有效性和安全性。II期临床数据显示,与安慰剂相比,orforglipron(12mg, 24mg, 36mg或45mg)治疗组患者第26周时体重减幅更大【8.6%(9.0kg)至12.6%(13.3kg),vs2.0%(2.1kg)】。
3.神州细胞启动14价HPV疫苗III期临床。神州细胞自主研发的14价人乳头瘤病毒(HPV)疫苗SCT1000登记启动一项III期临床(登记号:CTR20232472),计划入组18000名18~45周岁的健康女性受试者,评估SCT1000用于预防HPV6,11,16,18,31,33,35,39,45,51,52,56,58,59型HPV病毒感染所致的宫颈、外阴、阴道和肛门癌症,上皮内瘤样病变和AIS以及生殖器疣的有效性与安全性。
4.腾盛博药引进HBV中和抗体获批临床。腾盛博药引进的靶向乙型肝炎病毒(HBV)的中和抗体BRII-877(VIR-3434)获国家药监局临床默示许可,拟开发用于治疗慢性HBV感染。VIR-3434最初由Vir Biotechnology公司开发,旨在阻断所有10种基因型的HBV进入肝细胞,并降低血液中病毒颗粒和亚病毒颗粒的水平。公布于EASL大会上的Ⅱ期MARCH试验结果显示,BRII-877联合siRNA新药VIR-2218(BRII-835)治疗,可使患者HBsAg水平降低2.7-3.1 log10 IU/mL。
5.华东医药引进罗氟司特外用制剂。华东医药与Arcutis公司就后者新一代PDE4抑制剂罗氟司特(roflumilast)乳膏和泡沫制剂达成合作许可协议,获得roflumilast在大中华区以及东南亚地区的开发、生产和商业化授权,用于治疗包括斑块状银屑病、脂溢性皮炎和特应性皮炎等多种皮肤病。根据协议,Arcutis将获得3000万美元的预付款,6425万美元的监管和销售里程碑潜在付款,以及产品销售分成。
国际药讯
1.杨森PARP抑制剂复方获批治疗mCRPC。FDA批准强生旗下杨森PARP抑制剂niraparib和醋酸阿比特龙组成的复方片剂Akeega上市,联合强的松(prednisone)一线治疗BRCA阳性、转移性去势抵抗性前列腺癌(mCRPC)。在Ⅲ期MAGNITUDE试验中,联合治疗显著延长BRCA阳性亚组患者的放射学无进展生存期(19.5个月vs10.9个月;HR=0.53)。药物的安全性与获批的每种单药已知安全性一致。
2.强生GPRC5D/CD3双抗获批上市。强生GPRC5D/CD3双抗TALVEY(talquetamab)获FDA加速批准上市,用于治疗复发或难治性多发性骨髓瘤。在Ⅰ/Ⅱ期MonumenTAL-1试验中,talquetamab(405μg/kg,800μg/kg)在至少4种前期治疗的患者中达到73.0%和73.6%的总缓解率,非常好的部分缓解率分别为57%和58%。此前,talquetamab已分别被FDA和EMA授予孤儿药资格,和EMA授予的优先药物资格。
3.口服PDE4抑制剂银屑病Ⅱ期临床积极。日本Meiji Seika Pharma公司开发的新型磷酸二酯酶4(PDE4)抑制剂ME3183在治疗中重度斑块状银屑病的Ⅱ期临床达到主要终点。与安慰剂相比,ME3183治疗组第16周达到银屑病面积与严重程度指数(PASI)改善至少75%的患者比例明显更高。ME3183的安全和耐受性良好。详细研究将在医学会议上公布。
4.Aspen公司自体细胞疗法获批帕金森临床。Aspen Neuroscience公司自体细胞疗法ANPD001获FDA临床许可,计划开展Ⅰ/Ⅱa期临床试验,评估用于治疗中重度帕金森病(PD)患者的安全性与有效性。ANPD001是由患者自身皮肤细胞经重编程为诱导多能干细胞(iPSC)后分化而来的多巴胺神经元前体细胞(DANPC),旨在通过替代因病损失的多巴胺神经元来治疗帕金森病(PD)。
5.诺和诺德拟超10亿美元收购Inversago公司。诺和诺德宣布将以高达10.75亿美元的现金收购Inversago公司,并获得该公司临床期口服CB1反向激动剂INV-202,以及其他用于代谢和纤维化疾病的临床前项目资产。CB1是一种大麻素受体,在食欲调节和其他心脏代谢途径中发挥重要作用。INV-202已在Ib期试验中显示出减肥潜力,目前正在开展治疗糖尿病肾病(DKD)的II期试验。预计收购将在2023年底之前完成。
6.再生元逾1亿美元收购耳科基因治疗公司。再生元宣布将以约1.09亿美元收购基因治疗公司Decibel。两家公司此前已达成合作,联合开发耳科双载体AAV基因疗法DB-OTO用于治疗严重先天性听力损失。DB-OTO旨在通过AAV载体将OTOF基因的健康拷贝传递至耳蜗毛细胞,为因OTOF基因突变导致的先天性深度听力损失患者提供持久的生理性听力。目前,DB-OTO已获得FDA的孤儿药资格和罕见儿科疾病认定。
医药热点
1.内蒙古报告3例鼠疫确诊病例。据内蒙古锡林郭勒盟苏尼特右旗政府网站消息,8月12日,锡林郭勒盟苏尼特右旗报告2例鼠疫确诊病例,系8月7日报告鼠疫病例的丈夫和女儿,均为同一家庭共同居住人员。密切接触者均已按要求及时进行隔离管控,均未出现异常情况。专家提醒广大公众:要避免接触野生动物,不捕猎、不剥食、不携带疫源动物及其产品出疫区;发现病(死)鼠及其他动物要报告、发现疑似鼠疫病人要报告、发现不明原因的高热病人和急死病人要报告。
2.县级医院医疗设备配置标准出台。8月9日,国家卫健委官网发布一项推荐性卫生行业标准,即WS/T 819—2023《县级综合医院设备配置标准》。该标准旨在规范县级综合医院设备配置,并规定了万元及以上设备配置的基本原则。根据医院规模的不同,标准还提供了设备配置的品目和数量。标准适用于不超过1500床位规模的县级综合医院,实施时间为2024年1月1日。
3.陕西通报医疗反腐已处理937人。8月11日,陕西省纪委监委通报医疗领域的专项整治进展,截至8月上旬,全省各级共收到专项整治问题线索2521件,办结2371件,处理人员937人,47件问题线索移交至纪检监察机关。今年以来,通过主动归还、冲抵住院费等形式,累计退还患者及家属“红包”3470个。
评审动态
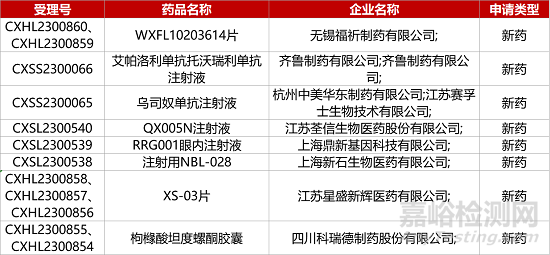
1. CDE新药受理情况(08月13日)
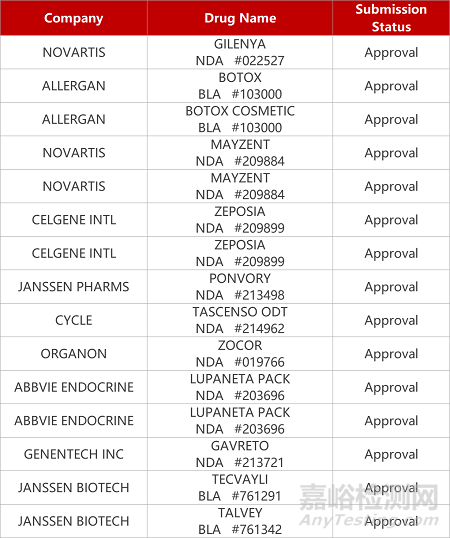
2. FDA新药获批情况(北美08月10日)