药物非临床研究是为评价药品安全性,在实验室条件下,用实验系统进行的各种毒性试验,包括单次给药的毒性试验、反复给药的毒性试验、生殖毒性试验、遗传毒性试验、致癌试验、局部毒性试验、免疫原性试验等。该研究是药物研发的基础工作,也是临床试验的重要基础数据,被认为是人体试验前的最后一道防线。
据国家药品监督管理局食品药品审核查验中心(CFDI)发布的《2021年度药品检查工作报告》显示,2021年GLP认证检查任务38个,不通过的任务1个。GLP认证检查发现的主要问题包括:质量保证部门履职能力不足;机构负责人资质不符合要求;实验动物设施设计与管理不到位;室验环节未能严格执行操作规程;计算机账户权限分级设置不合理等。国内企业在药物研发中,往往会忽略临床前研发中的质量管理,下面本文就着重阐述一下药物临床前研发阶段质量管理体系的搭建所包含的内容。
一、临床前质量管理体系方面的法规
药品临床前研究质量管理涉及的法规政策主要包括《中华人民共和国药品管理法》《药品注册现场核查管理规定》《药品生产质量管理规范》(GMP)《药物非临床研究质量管理规范》(GLP)这4个。
其中,只有GLP是专门针对临床前研发质量管理的,更具体的说,GLP更多关注安全评价实验室的研发质量管理。GLP是药物非临床研究的质量管理和保证体系。2006年,我国《药物非临床研究质量管理规范》正式实施,2017年进行了修订。
GLP适用于为申请药品注册而进行的药物非临床安全性评价研究,并要求以注册为目的的其他药物临床前相关研究活动参照该规范执行,关注组织机构和人员、设施、仪器设备和实验材料、实验系统、标准操作规程、研究工作的实施、质量保证及资料档案等方面的行为规范和数据的真实、准确、完整。
二、临床前质量管理体系的建立
1、风险控制理念
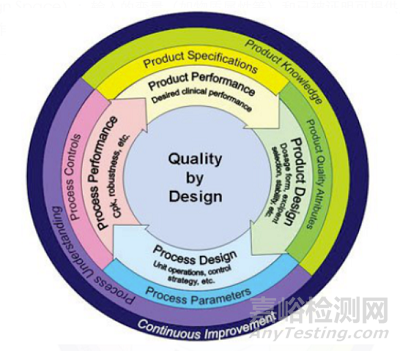
风险控制理念应贯穿药品研发全程,采用以质量源于设计(QbD)的理念进行系统研究设计和风险评估。如在药学研究阶段的风险评估连接了物料属性、 工艺参数和药品关键质量属性,有助于实施QbD的研究设计,进而保证后续连续稳定地生产出合格产品。
图1:质量源于设计QbD(来源:网络)
2、组织机构和人员
(1)有明确的岗位职责,由指定具备资格的人员担任,并设立独立的临床前研发质量管理归口部门或专员,提供包含人员、场地、仪器在内的基础设施,负责企业内部临床前研发质量管理体系编制及质量核查工作,以此避免人员分工和权限上的交叉。
(2)加强科研人员质量体系培训。为避免科研人员难以识别药品研发过程中存在的质量风险,应加强对其的质量体系培训。培训包括但不限于入职培训、岗前培训和在职员工的持续培训,培训类目包含但不限于基础培训、文件管理、项目管理、仪器设备管理、物料管理、质量管理、法律法规知识等。
3、研究场所和仪器设备
实验场所需保证环境条件满足所开展研究项目的要求,如温湿度、日常物料储存/转运、空间隔离、安全措施、危废处置等条件。并注意设置日常出入清洁标准,避免(交叉)污染。
仪器设备要进行分类管理,并建立可操作性的标准操作规范(SOP),包括对相应的检定或校准、验证、维护、清洁工作进行规定,专设负责人对设备的运行和日常维护进行监督,保障设备的正常运行。
全面规范化的设备档案管理涵盖设备购买到淘汰的全过程,其包括使用、维护、借出、维修等各个环节,旨在确保研究活动的可追溯性。另外,档案保管设施应设有接触权限、有效控制并监测各种危害因素。电子档案存储的组件应确保电子档案访问和存储安全。
4、实验系统和实验材料
实验系统包括GLP中的动物、植物、微生物 以及器官、组织、细胞、基因等;实验材料包括广泛的样品或受试品、对照品、对照制剂及其他物料等。这两者统称物料。
对于物料,需要指定专人进行保管并记录使用情况。管理内容主要包括管理相关的资料信息、保证标签准确清晰、保证储存条件、保证各种过程中的稳定以及足够的留样量。对于试制样品、对照品、对照制剂、受试品等关键物料,其保存期限应保证审评的需要。
如在药理毒理研究的实验动物管理中,应注重动物福利、健康状况、所处环境卫生及营养状态等方面。这些因素应被详细记录并妥善归档,以确保实验系统的质量与适用性。
5、确认与验证
确认或验证的目的是确保药品生产关键要素可控,以保证持续产出符合要求的产品。如一般厂房、设施、设备和仪器需确认,生产工艺、操作规程、检验方法和清洁方法则需保持持续验证状态。具体内容要经过风险评估来确定。
6、文件及档案
档案管理基本包括体系文件、原始记录、各种设备记录、台账、项目资料、试验异常或失败记录、实验变更记录、研发相关文献、支持申报材料等。
文件是体系完善和有效落实的依据,是质量管理体系的核心。文件分为3个层次,依次为质量手册;管理标准(SMP)、技术标准(STP)、操作标准(SOP);记录类。原始记录是指实验数据、文字、声像等原始资料,需格式统一、编号唯一,确保真实、准确、完整。
对于临床前研发阶段的档案,应按重要性分级并由不同职级人员负责管理保存。
7、质量管理
质量管理包括质量保证、质量控制、数据完整性、偏差管理和变更管理。
质量保证被认为是贯彻执行GLP精神、确保研究质量的关键环节。其一般通过质量审计的形式体现,在日常中的具体活动为研发记录、方案和报告的审计;体系运行过程中研究人员对问题的反馈;质管人员的审查评估。
质量控制在药学生产阶段属历年现场检查缺陷的高发项,其特殊项主要包括取样人员需经授权;检验方法需经验证或确认;所有的检查检验标准都必须经过批准;检验记录应包含依据的质量标准和检验操作规程;完整规范的留样管理等。
数据完整性目前主要需注意规范性问题,如数据与记录无缺失、有效控制操作系统与软件管理、计算机系统管理等。可从制定适宜的数据管理规定及对相关人员进行定期、循环培训考核这两方面着手。
偏差管理的形式和要求依据研发阶段和性质的不同而不同,如若在研发初期则简单记录异常即可,若在研发后期则需走偏差处理单。另外,只要涉及数据可靠性的偏差,就需特别关注。
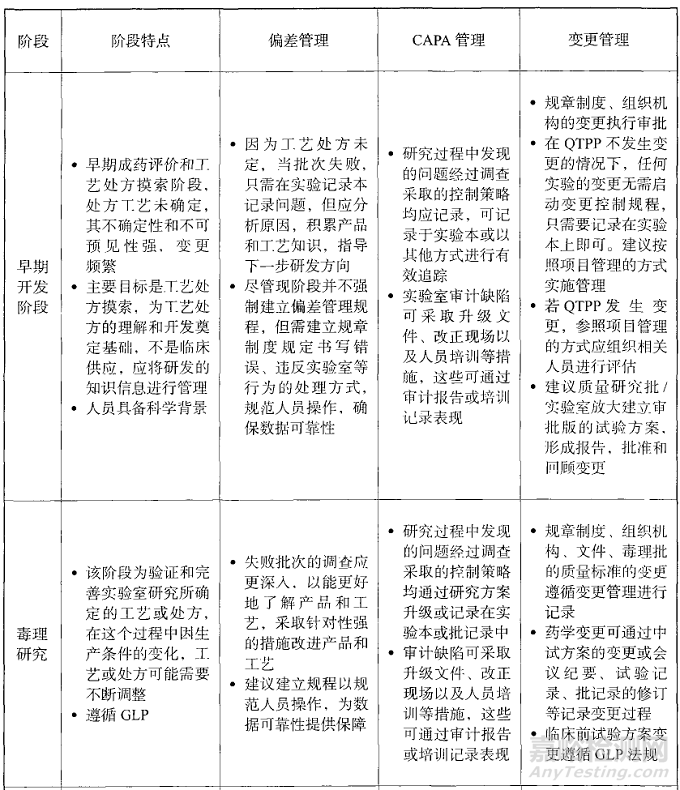
变更管理:据GMP指南建议,在早期开发阶段,在QTPP不发生变更的情况下,任何实验的变更无需启动变更控制规程,只需要记录在实验本上即可。建议按照项目管理的方式实施管理。若QTPP发生变更,参照项目管理的方式应组织相关人员进行评估。临床前试验方案 变更需遵循GLP法规。
图1:药品研发阶段的质量系统建立建议(来源:药品GMP指南,第二版)
8、工作实施
药学生产中的工作实施部分为“生产管理” 的内容,不同于其他实验室的方案报告,实施的依据是批准的规程文件和记录模板,并完全执行,一旦出现偏差,应进行全面的调查评估;生产管理中注重对清洁的要求,防止污染。
总结:随着药物研发监管的不断发展成熟,临床前研发阶段的质量管理必将成为国家药监局未来法律法规体系完善的一个重点。而建立完善的质量管理体系,是企业在开展研发生产质量管理工作中最重要的一点。药品研发企业提前在此进行规划部署,有利于规避合规风险,保障药物质量,提升药物注册申报成功率,促进企业的长远发展。
参考资料:
[1]陈一飞,唐黎明,李刚.中国药物非临床安全性评价研究机构现场检查类型与常见问题讨论[J].中国医药工业杂志,2021,52(05):709-713.DOI:10.16522/j.cnki.cjph.2021.05.019.
[2]梅妮,张皖晋,陈一飞.美国FDA发布的药物非临床研究警告信分析[J].中国新药与临床杂志,2023,42(06):406-410.DOI:10.14109/j.cnki.xyylc.2023.06.13.
[3]程英,汪飞,黄丽晶等.药物研发全过程质量管理体系的构建和运行[J].中国药事,2021,35(06):631-640.DOI:10.16153/j.1002-7777.2021.06.004.
[4]赵静.浅谈新监管环境下药物研发的质量管理[J].化工管理,2020(02):27-28.
[5]药物研发管理第一道防线——创新药企药物临床前研发质量管理体系的建立与完善. 安永EY.2023-06-06.