导语:本文着重介绍临床评价的三种路径(免临床对比、同品种等同性和临床试验)三者之间的关系,以为诸君在研发过程中提供点滴参考。
第一部分 监管信息
在新的注册管理办法中,临床评价的定义是采用科学合理的方法对临床数据进行分析评价,以确认医疗器械在适用范围内的安全性和有效性。这使得临床数据在原定义中得到了更高度的概括和总结。但在评价过程和要求上,这并未发生实质性变化。新注册和备案管理办法发布后,对于已进入豁免目录的产品,目前应不在现有临床评价范围内,这与旧版注册管理办法有较大变化。临床评价定义方面,按照现行有效法规,存在两条路径:第一条是根据同品种医疗器械的临床文献资料、临床数据进行临床评价;第二条是通过临床实验进行临床评价。
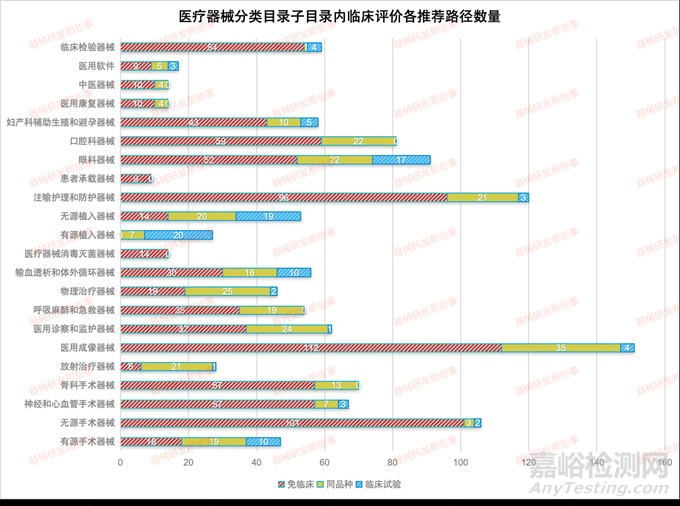
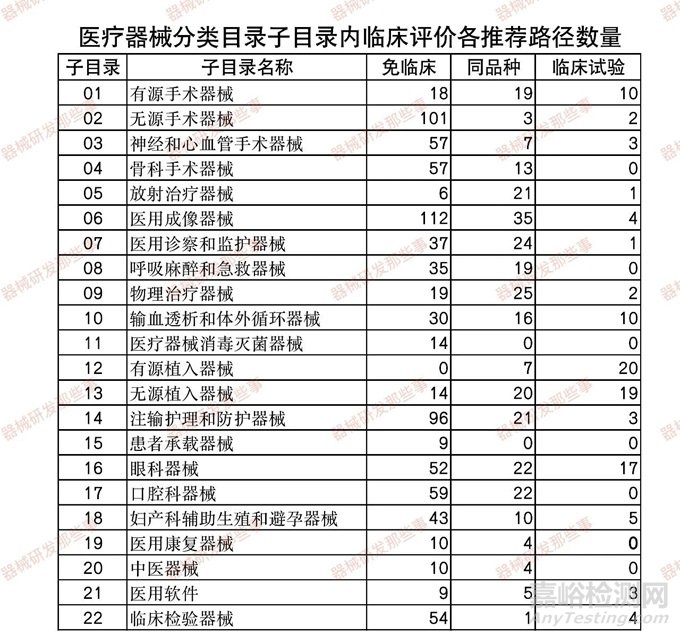
前文《浅谈医疗器械临床评价路径选择攻略》根据CMDE发布的《医疗器械分类目录》子目录01-22相关产品临床评价推荐路径的通告(2022年第20、24和30号) 相关内容,统计了在各个子目录下的产品对应推荐的临床评价路径的数量,如下表和下图所示。
从图中可以看出,涉及到临床试验的子目录相关产品占比8%,免临床评价的占比68%,同品种对比的占比24%。其中涉及临床试验的主要集中在12有源植入器械、13无源植入器械和16眼科器械以及01有源手术器械。由于涉及产品众多,作者已经将其推荐路径按照《医疗器械分类目录》的字母分别收集了子目录01-22类相关产品的临床评价推荐路径,可在微信公众号内回复 临床评价路径 获得01-22类器械的临床评价路径选择目录。
根据现有法规,无论选择哪条路径(临床试验或同品种等同性论证),均应有一份临床评价报告(微信公众号内回复 临床评价报告 即可获得相应报告的要求),详细介绍产品的适用范围、设计特征和研发背景、临床评价范围、临床评价路径等。如果大家递交过立卷资料,应发现这部分内容比原立卷中新增的文件。最初仅进行临床试验,无需再递交临床评价报告,且这两条路径之间并非非此即彼,可能存在交叉或组合情况。现有路径中存在同品种医疗器械、临床文献资料和临床数据进行临床评价,这样可以了解等同性论证在医疗器械临床评价中的具体环节。结合相相应路径,再按照法规文件要求进行相应的法规文件要求进行制定。这有助于大家理解等同性论证要求和设计初衷。
第二部分 临床评价之间的相互关系
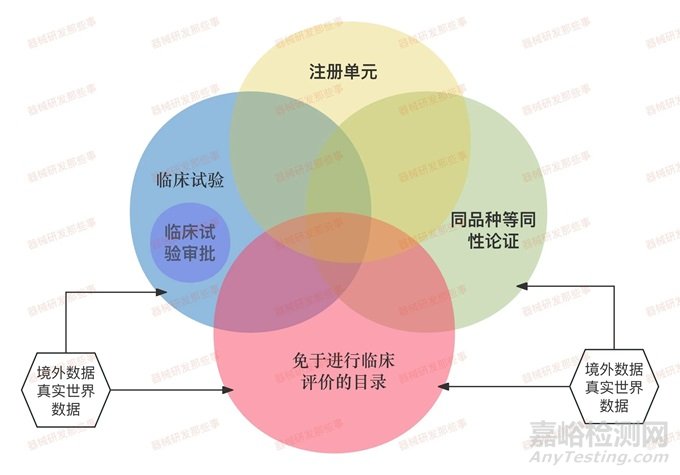
如下图所示,设计了一张相互关系图,便于大家理解。临床评价有些老师与注册单元挂钩,有些老师与豁免目录挂钩,各种情况都有。整体情况来看,临床评价不外乎临床试验、同品种等同性和免于进行临床评价目录。尽管现在免于临床评价已与临床评价没有直接关联,但在同一条路线下进行,包括注册单元,中间都会存在互相交叉和重叠的情况。
有可能你在申报某一产品时,除了临床实验和同品种路径之外,还有可能存在交叉情况。例如,在进行同品种临床评价路径时,还需要递交相应的免于进行临床评价。当产品中有多个功能,一部分功能属于免临床目录,另一部分属于同品种,这时可能会存在交叉重叠的情况。
临床试验和注册单元并非一一对应,而是需要结合实际情况进行判断和组合。我认为无论我们选择临床评价的哪一路径,整体之间的关系和概念都应该有一个最基本的了解。需要注意的是,目前同品种等同性论证选择的对比器械应已在境内获准注册。
第三部分 真实世界数据与临床评价的关系
基于真实世界数据形成的真实世界证据可支持医疗器械全生命周期临床评价,涵盖上市前临床评价及上市后临床评价。根据2024年发布的《医疗器械真实世界研究设计和统计分析注册审查指导原则(2024年第3号)》(回复 真实世界 即可获得)中对真实世界数据的描述:在当前发展阶段,真实世界证据在医疗器械临床评价中,主要作为已有临床证据的补充。
《真实世界数据用于医疗器械临床评价技术指导原则(试行)(2020年第77号)》(回复 真实世界 即可获得)中详细介绍了真实世界数据用于临床评价的常见情形:
(一)在同品种临床评价路径中提供临床证据
(二)用于支持产品注册,作为已有证据的补充
(三)临床急需进口器械在国内特许使用中产生的真实世界数据,可用于支持产品注册,作为已有证据的补充
(四)作为单组试验的外部对照
(五)为单组目标值的构建提供临床数据
(六)支持适用范围、适应症、禁忌症的修改
(七)支持在说明书中修改产品的临床价值
(八)支持附带条件批准产品的上市后研究
(九)用于高风险植入物等医疗器械的远期安全性和/或有效性评估
(十)用于治疗罕见病的医疗器械全生命周期临床评价,加快其上市进程,满足患者需求
(十一)上市后监测
根据《中国医药报》2023年11月09日的报道,截至报告日已有2批13个品种被纳入医疗器械真实世界数据应用试点(海南博鳌乐城国际医疗旅游先行区),其中,7个品种共9个产品获批上市。
结束语:详细介绍了临床评价各路径之间的相互关系,同时介绍真实世界数据与临床评价的关系。对于真实世界数据研究在我国处于快速发展的阶段,同时我国在海南建立了相应的试点,基于真实世界数据证据可用于临床评价的情形,值得思考未来在产品研发过程中的如何利用好真实世界数据帮我我们产品的研发及销售。