有小伙伴提出了一个很有意思的问题,毒理试验能进行非对称设计吗?恢复期组别是否可以不在所有剂量组体现?恰逢最近在整理类似主题的文章,一并发出,供大家讨论。
非临床研究中关于毒性反应的可逆性评估对于指导临床设计至关重要。可逆性的考察通常通过设置恢复期组动物实现。恢复期组动物与主研究组同样方案给药,不同的是在末次给药后动物不处死,继续观察一段时间,评估毒性反应的可逆性,可以是部分可逆,也可是完全可逆。关于恢复期,ICH S6重复给药毒性试验部分有相关描述“试验设计一般应包括恢复期,以确定药理学/毒理学作用的可逆性或潜在恶化和/或潜在的延迟毒性效应”。同时,ICH S6还指出“Recovery from pharmacological and toxicological effects with potential adverse clinical impact should be understood when they occur at clinically relevant exposures”。这里面有个关键词——临床相关暴露量。什么叫临床相关暴露量?ICH M3提示≤10倍临床拟用剂量的暴露量。那么如果在临床相关暴露量下,动物无毒性发现,或者动物毒性发现高于临床相关暴露量,是不是就不需要设置恢复期动物?或者说,如果需要设置恢复期,可以仅在其中1个剂量水平设置吗?
ICH M3 Q&A关于不需要设置恢复期的情况也列举了几个例子,比如已发现的毒性明确不可逆;已发现的毒性仅在高于临床相关暴露量组发现;已发现的毒性已在同类产品中观察到,且明确毒性可控;已发现的毒性在短期重复给药毒性中已经观察到,且更长周期毒性试验中未见更严重趋势。ICH S9 Q&A也有类似理念描述“一般毒理学研究应提供恢复潜力的科学评估,至少在一个研究或一个剂量水平设置恢复期来获得”。不难看出,ICH对于恢复期的设置是有一定灵活性的,允许结合具体项目进行合理设计。
以单克隆抗体为例,单抗因其特异性好,大部分毒性发现以其靶点的药理学作用放大为主。恢复期设置方面是否有更多的设计空间?但是,从Sewell等人统计的2010-2013年间53个单抗,84项毒理学研究(有的抗体是两个相关动物种属)发现,69项试验设置了恢复期动物,设置的原因有两点,一是公司的标准实践指南要求,二是预期的监管要求。毫无疑问,每项试验,每个剂量组均设置恢复期,最起码内部无责,外部监管也无风险。
随着ICH S6等指南的颁布,以及动物“3R”原则的呼声愈发强烈,叠加抗体类项目的大量增加,关于恢复期的科学、合理设计的话题值得进一步深入讨论。尤其是单抗大多需要采用非人灵长类动物进行安评,从伦理角度和资源可及性,均应尽可能减少动物的使用。Sewell等人的调研比较早期,不能代表工业界和监管机构的最新认识。
由NC3Rs、AbbVie、Bristol Myers Squibb、GlaxoSmithKline、Genentech、Janssen、Merck & Co、AstraZeneca、Sanofi-Aventis、Roche、Pfizer、Novartis等十几家药企和组织对2015-2019年启动研究的51个单抗毒理试验恢复期设置情况进行了统计分析。共计94项研究(83项非啮齿、11项啮齿)在2015-2019年启动,24项研究(19项非啮齿、5项啮齿)于2015年之前启动。这里稍微解释下,有的单抗支持首次临床试验的毒理试验是在2015年前完成的,2015-2019年开展的支持Ⅲ期临床或BLA的更长周期毒理研究。51个抗体毒理研究所用种属、研究周期及有无设置恢复期如下表所示,×代表未设置恢复期,√则相反。
51个抗体中,43个采用的单一种属,且42/43采用的非啮齿类开展的研究,主要是食蟹猴,有一个抗体采用的转基因动物作为单一种属。8个抗体采用的双种属开展的毒理研究,其中4个在更长周期毒性试验中缩减为单种属,另外4个则依然采用的双种属。
从表格中不难看出,有4个项目在IND enabling和后续更长周期毒理研究中,均未设置恢复期(3、18、35和40号抗体)。其中,3个产品的适应症为炎症,1个是肿瘤。具体原因没有披露。25个抗体在短期和长期毒理研究中均设置了恢复期。12个抗体仅在短期毒理研究中设置了恢复期,7个抗体仅在更长周期毒理研究中设置了恢复期。
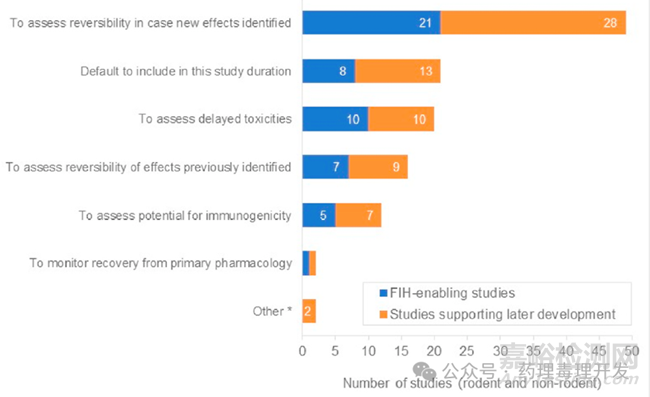
设置恢复期的主要原因如下图所示,反馈最多的原因是可能鉴定出的新的毒性作用的可逆性,公司的一些默认做法以及潜在的延迟毒性评估。但实际上ICH S6(R1)里面有明确描述,The purpose of the non-dosing period is to examine reversibility of these effects, not to assess delayed toxicity. 评估延迟毒性并不是设置恢复期的目的。企业反馈的关于恢复期设置的原因中,还有一条是检测可能的免疫原性。关于这点,ICH S6(R1)里面同样有过描述,the addition of a recovery period just to assess potential for immunogenicity is not required. 设置恢复期对于ADA的评估并无额外价值。这也说明ICH的指南即使在一些大的药企中,也未完全的严格落于实践。大多还是基于避险心理,无论是来自公司层面的,还是注册层面,亦或是纯粹对未发生事件的担心等原因,默认了恢复期的存在。
在55项非啮齿类含恢复期的毒理研究中,28/55个仅在对照组+1个供试品给药组设置恢复期。这其中,23/28项试验仅设置在高剂量组。22/55项研究在所有剂量组均设置了恢复期。4/55项研究在>1个剂量组设置了恢复期,但并不是所有剂量组。1/55项研究仅在高剂量组包含恢复期,其它给药组及对照组均未设置。另外提一句,9项啮齿类动物毒理研究中,大部分(7/9)在所有剂量组均设置了恢复期。
以上是国外MNC企业就2015-2019年间几十个抗体进行的问卷式调查,未披露具体产品名称。已上市的单抗很多,再举几个有名有姓的例子。2018年8月8日,FDA批准上市的CCR4抗体Poteligeo,开展了28天和26周食蟹猴单种属重复给药毒理研究,在28天短期重复给药毒理试验中设置了3个月恢复期,26周试验中未见设置。2020年FDA批准上市的IL-6R抗体Enspryng,开展了4周和26周食蟹猴重复给药毒性研究,短期研究未设置恢复期,长期26周的研究设置了13周的恢复期。2023年10月26日,FDA批准了Eli Lilly的IL23p19单抗Omvoh上市,用于治疗溃疡性结肠炎。Omvoh非临床研究采用食蟹猴作为相关种属,开展了4周和6个月两个给药周期的重复给药毒理研究。4周重复给药毒性试验中设置了8周的恢复期,而6个月毒理研究中未见恢复期设置。不只抗体类产品,CRESEMBA是FDA于2015年批准上市的艾沙康唑胶囊,用于治疗侵袭性曲霉菌病和侵袭性毛霉菌病成人患者,在其食蟹猴13周重复给药毒理试验中,设置了4周恢复期,但仅在阴性对照和高剂量组包含恢复期动物,且每个性别仅设置了1只动物。在其食蟹猴39周重复给药毒理试验中,同样设置了4周恢复期,同样仅在阴性对照和高剂量组包含了恢复期动物,每个性别设置了2只动物。案例很多,不再进一步展开。
相较于早期的一些回顾性数据,恢复期的设置近些年呈减少的趋势。恢复期的设置与否以及怎么设置还是要回归到科学层面进行思考。既不能默认所有试验,所有剂量组均设置恢复期,也不可走向另外一个极端,否定恢复期的作用。有很多问题值得去进一步讨论,比如如果有两个相关种属,且毒性表现类似,是否可以仅在其中1个种属中设置恢复期组?比如如果设置恢复期,能否仅在其中1组或非全部供试品给药组设置?比如如果可以在部分组别设置恢复期,是在高剂量还是更接近临床相关暴露量剂量组?比如恢复期的时间应该多久,预设的恢复期是否可以在试验过程中根据供试品毒性表现进行动态调整?比如阴性对照组动物设置恢复期的意义是什么,如果有充分的历史对照数据,是否还有必要继续设置?
以上都是些很有意思的话题。ICH S6和M3或多或少都有相关描述。也可以翻一翻已经批准上市的单抗或者其他同类别药物的药理毒理研究数据,对恢复期设置的了解也能更多一些。恢复期的科学设置是建立在充分的预试验及对产品的充分了解基础之上,是一个开放的话题,绝不是默认设置那么简单。恢复期设置也是一个前瞻性又稍显“敏感”的话题,工业界的调研毕竟代表不了监管机构的态度。还是秉承ICH M3和S9 Q&A中给出的一些原则,结合充分的文献调研和前期试验数据,企业可以尝试与监管机构就毒理研究方案或策略进行沟通,以求最优化试验设计。