您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-03-20 18:12
本研究旨在建立乳酸环丙沙星的微生物限度检查方法以及乳酸环丙沙星氯化钠注射液的无菌检查方法。试验方法严格遵循《中国药典》2020 年版四部的相关规定进行方法适应性试验。试验结果显示,乳酸环丙沙星原料药采用微生物计数方法适用性试验,各菌回收比值均在 0.5 ~ 2.0 之间;控制菌大肠埃希菌可检出阳性试验菌。乳酸环丙沙星氯化钠注射液无菌检查方法采用薄膜过滤法,6 种试验菌均能检出。基于以上结果,本研究得出结论:乳酸环丙沙星的微生物限度检查方法以及乳酸环丙沙星氯化钠注射液的无菌检查方法,均适宜采用薄膜过滤法进行。
环丙沙星展现出了显著的抑菌效果,目前在临床上主要用于治疗由敏感菌引起的泌尿系统和消化系统感染等疾病,属于第三代喹诺酮类抗菌药物 [1]。乳酸环丙沙星是环丙沙星与乳酸形成的盐类,与环丙沙星相比,乳酸环丙沙星具有更高的药物吸收率,以及抗菌谱广、穿透力强、组织浓度高的特性 [2-4]。目前,药品质量标准检查项目中的微生物学检查是确保用药安全的关键指标之一 [5]。根据《中国药典》2020 年版四部通则,对于需要控制药品质量的微生物检验方法有明确的规定:必须对其相关检查方法进行验证 [6],以避免因方法不当导致的漏检和误判。本研究根据《中国药典》2020 年版四部通则中无菌检查以及微生物限度检查的要求 [7],以乳酸环丙沙星原料及其制剂为研究对象,对微生物限度和无菌检查的方法适应性试验进行了全面的研究,旨在为药品的生产和质量检验提供可行、有效、安全、可控的依据。
1.材料与仪器
1.1 仪器
本研究使用了 HTY-302G 微生物限度检测仪(浙江泰林生物技术股份有限公司)、BHC-1300 IIB2 生物安全柜(广州苏信环保科技有限公司)、LRH-800生化培养箱(韶关市泰宏医疗器械有限公司)、YXQ-LS-100SII 立式压力蒸汽灭菌锅(上海博讯实业有限公司医疗设备厂)、YT-601 集菌仪(杭州盈天科学仪器有限公司)以及层流净化工作台(广州苏信环保科技有限公司)。
1.2 样品与试剂
试验中使用了乳酸环丙沙星原料药,批号分别为 210810,210709,220109,由浙江国邦药业有限公司提供;以及乳酸环丙沙星氯化钠注射液,批号分别为 221202101,221203101,221203102,由广东大翔制药有限公司提供。
1.3 试验用菌种
试验所用菌种包括金黄色葡萄球菌 CMCC(B)220422、黑曲霉 CMCC(B)220805、白色念珠菌 CMCC(B)220816、铜绿假单胞菌 CMCC(B)220806、大肠埃希菌 CMCC(B)220915、枯草芽孢杆菌 CMCC(B)220402、生孢梭菌CMCC(B)220519,均购自北京三药科技开发公司。
1.4 培养基
试验中应用了麦康凯琼脂培养基(批号:07221101)、胰酪大豆胨琼脂培养基(TSA,批号:02221103)、麦康凯液体培养基(批号:06221101)、胰 酪 大 豆 胨 液 体 培 养 基( 批 号:02221101)、沙氏葡萄糖琼脂培养基(SDA,批号:04221101)[8]、硫乙醇酸盐流体培养基(批号:03221103),这些均购自北京三药科技开发公司;pH 7.0 氯化钠 - 蛋白胨缓冲液(批号:140424)以及含 0.2 mol 氯化镁的 0.1%无菌蛋白胨水溶液(批号:28221203)为实验室自配。
2.方 法
2.1 菌液制备
使用 0.9% 无菌氯化钠溶液将金黄色葡萄球菌工作菌株稀释至不超过100 cfu/mL 的菌悬液,生孢梭菌、大肠埃希菌、铜绿假单胞菌、枯草芽孢杆菌、黑曲霉、白色念珠菌的制备方法相同 [9]。
2.2 微生物限度检查用供试液的制备
称取 10 g 乳酸环丙沙星原料药,用缓冲液稀释至 100 mL,振摇后静置,取上清液 10 mL,再次加入缓冲液至100 mL,制备成 1:100 的供试液,振摇后静置,取上清液进行检测。
2.3 计数方法适用性试验
2.3.1 试验组
需氧菌组:用缓冲液润湿滤膜,吸取供试液 1 mL 进行薄膜过滤,用缓冲液冲洗 5 次,每次冲洗量为 100 mL,最后一次冲洗液中加入 1 mL 金黄色葡萄球菌试验菌的菌悬液,过滤后取下滤膜,贴在胰酪大豆胨琼脂培养基(TSA)中,进行平行试验 2 份 [10] :枯草芽孢杆菌、铜绿假单胞菌、白色念珠菌和黑曲霉的处理方法相同。需氧菌的平皿在30 ~ 35 ℃环境中培养不超过 3 天;霉菌和酵母菌在 30 ~ 35 ℃的环境中培养不超过 5 天。按薄膜过滤法测定菌数,并取平均值。3 批样品分别进行试验。
霉菌和酵母菌组:采用薄膜过滤法进行检验,操作与需氧菌组相同,最后一次冲洗液中加入 1 mL 白色念珠菌试验菌的菌悬液,过滤后取下滤膜贴于沙氏葡萄糖琼脂(SDA)中,进行平行试验 2 份;黑曲霉的处理方法相同。将以上平皿放置在 20 ~ 25 ℃环境中培养不超过 5 天,按薄膜过滤法测定菌数,并取平均值。3 批样品分别进行试验。
2.3.2 供试品对照组
取“2.2”项下制备好的供试液,用 0.9% 无菌氯化钠稀释液代替菌液,其他操作与“2.3.1”项下相同。
2.3.3 菌液对照组
取稀释液代替供试液,其他操作与“2.3.1”项下相同。
2.3.4 计算菌液对照组
回收率比值分别按下列公式进行计算。

2.4 控制菌检查方法适用性试验
2.4.1 试验组
与需氧菌同样采用薄膜过滤法检验,最后一次冲洗液中加入 1 mL 大肠埃希菌试验菌的菌悬液,将滤膜转移到 100 mL 胰酪大豆胨液体培养基上,30 ~ 35 ℃环境中培养 18 h ;取上述 1 mL 培养液接种到 100 mL 麦康凯液体培养基中,42 ~ 44 ℃环境中培养24 h ;将麦康凯液体的培养物进行划线接种在麦康凯琼脂培养基的平板上,30 ~ 35 ℃环境中培养 18 h[11]。3 批样品分别进行试验。
2.4.2 阳性对照组
取小于 100 cfu 大肠埃希菌菌液,依法按薄膜过滤法检查,每次冲洗量为 100 mL,冲洗次数为 5 次,将滤膜转至 100 mL 胰酪大豆胨液体培养基中,其他操作与试验组相同。
2.4.3 阴性对照组
取胰酪大豆胨液体培养基 100 mL,30 ~ 35 ℃环境中培养 18 h ;其他操作与相应控制菌试验组相同。
2.5 乳酸环丙沙星氯化钠注射液无菌方法适用性试验
2.5.1 试验组
取一次性使用全封闭式集菌培养器,过滤常规检验量的乳酸环丙沙星氯化钠注射液作为供试品组,用含 0.2 mol/L氯化镁的 0.1% 无菌蛋白胨水溶液进行冲洗过滤 8 次,注入 100 mL 硫乙醇酸盐流体培养基,再加入 0.2 mol/L 无菌氯化镁溶液 5 mL,接入金黄色葡萄球菌悬液 1 mL[12]。大肠埃希菌、生孢梭菌均同法操作。将以上培养基置于33 ℃的条件下培养 5 天;同法操作,白色念珠菌、黑曲霉、枯草芽孢杆菌则注入 100 mL 胰酪大豆胨液体培养基后分别加入菌液 1 mL,将培养器置 23 ℃的条件下培养 5 天,逐日观察记录结果 [13]。3 批样品分别进行试验。
2.5.2 阳性对照组
取装有相同体积培养基的容器,加入 0.2 mol/L 无菌氯化镁溶液 5 mL,再接入等量的试验菌作为对照。6 种试验菌分别进行无菌方法适用性试验,放置在规定的温度中培养 5 天,每日观察,记录结果 [13]。
2.5.3 阴性对照组
以含 0.2 molL 氯化镁的 0.1% 无菌蛋白胨水溶液代替供试品,分别在过滤后向集菌培养器注入硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基,再分别加入 0.2 mol/L 无菌氯化镁溶液 5 mL作为阴性对照。
3.结 果
3.1 乳酸环丙沙星需氧菌总数、霉菌和酵母菌总数计数验证结果
经过对 3 批乳酸环丙沙星原料药的计算分析,结果显示 5 种试验菌株的回收率比值均在 0.5 ~ 2 的范围内,这表明所采用的供试液制备方法和计数方法适用于乳酸环丙沙星原料药的微生物计数。详细结果参见表1。
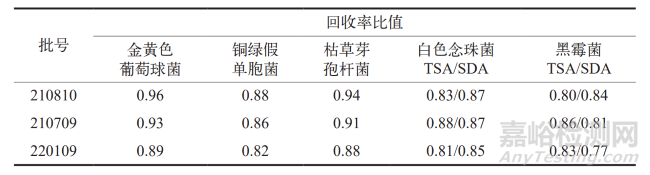
表1 各验证菌的回收率
3.2 乳酸环丙沙星大肠埃希菌验证结果
表 2 显示,在 3 批乳酸环丙沙星样品的阴性对照组中未检出大肠埃希菌,而试验组与阳性对照组中均检出大肠埃希菌。因此,可以采用本方法对乳酸环丙沙星原料药进行大肠埃希菌的检查。表 2 中“+”表示培养液浑浊,有菌生长,“-”表示培养液澄清,无菌生长,后续表格中相同。

表2 大肠埃希菌验证结果
3.3 乳酸环丙沙星氯化钠注射液无菌验证结果
通过表 3 的验证结果,对 3 个批次的乳酸环丙沙星氯化钠注射液样品进行薄膜过滤法过滤后,所有试验菌均在规定时间内生长良好。与对照组相比,供试品组菌液浊度无明显差异,生长状况良好,因此可以使用此方法进行无菌试验。这表明在该条件下乳酸环丙沙星氯化钠注射液无抑菌作用,该方法适用于乳酸环丙沙星氯化钠注射液无菌检查。
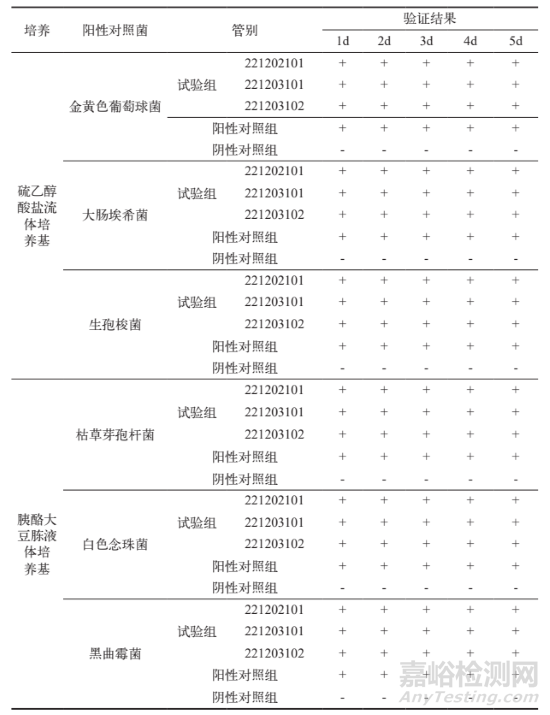
表3 无菌验证结果
4.讨 论
注射用乳酸环丙沙星是一种广谱抗菌剂,也是较早投入临床应用的喹诺酮类药物之一,尤其对需氧革兰氏阴性菌感染表现出良好的疗效。由于其价格低廉且疗效显著,因此在临床实践中得到了广泛的应用。本文按照《中国药典》2020 年版的四部通则,确定了乳酸环丙沙星原料药的微生物限度检查方法以及乳酸环丙沙星氯化钠注射剂的无菌检查方法。乳酸环丙沙星及其制剂具有一定的抑菌性,通过薄膜过滤法可以有效去除药物的抑菌性,从而提高检验的效率与准确性 [14-15]。
在试验过程中发现,采用 1 :100稀释级的乳酸环丙沙星供试液,以pH7.0 无菌氯化钠 - 蛋白胨缓冲液作为稀释液和冲洗液,试验菌株回收率可以达到 50% ~ 200% 的要求,因此,可以使用此方法对乳酸环丙沙星原料药进行微生物学限度检查。为了去除其制剂的抑菌性,采用了含 0.2 mol/L 氯化镁的 0.1% 无菌蛋白胨水溶液进行冲洗,并加入 0.2 mol/L 无菌氯化镁溶液5 mL。试验结果表明,通过该方法可以中和其抑菌作用,因此可以使用此检查方法对乳酸环丙沙星氯化钠注射液进行无菌检查。
参考文献
[1] 刘露 . 哌拉西林钠他唑巴坦钠联合乳酸环丙沙星治疗支气管扩张症伴铜绿假单胞菌感染患者的临床效果 [J]. 中国药物经济学,2021,16(08):66-69.
[2] 萧抒蓉,李世良 . 头孢哌酮 / 舒巴坦与环丙沙星治疗老年支气管扩张急性加重临床比较 [J]. 北方药学,2018,15(2):121-121.
[3] 林国权,吕竹芬,徐洁媚,等 . 乳酸环丙沙星的制备 [J]. 中国医药工业杂志,1993(11):484-485.
[4] 彭昌 . 环丙沙星联合支气管肺泡灌洗治疗老年支气管扩张感染疗效观察[J].深圳中西医结合杂志,2017,27(21):88-89.
[5] 胡亚英,马欣,陈睿,等 . 复黄片微生物限度检查方法适用性探究 [J]. 中成药,2020,42(03):788-791.
[6] 韦倩,邱琼华,李隽永,等 . 散结粉微生物限度检查方法学研究[J]. 工业微生物,2024,54(05):51-55.
[7] 国家药典委员会 . 中华人民共和国药典 [M].4 部 . 北京:中国医药科技出版社,2020:162-164.
[8] 唐菱,侯晓军,周剑,等 . 硫酸新霉素凝胶微生物限度检查方法的适用性试验 [J]. 中国抗生素杂志,2016,41(09):680-683.
[9] 符少茹,杜代妹 . 注射用 rhCNB无菌检查方法学研究 [J]. 健康之路,2017,16(05):256.
[10] 王振伟,孙亦粉,李海伦,等 . 呋锌软膏的微生物限度检查适用性考察 [J]. 按 摩 与 康 复 医 学,2022,13(24):63-66.
[11] 史银基,漆也,马海红,等 . 药用复合膜微生物限度检查方法的建立 [J]. 新疆中医药,2016,34(04):48-51.
[12] 肖建光,欧国栋,赖珊,等 . 注射用头孢尼西钠无菌检查方法的优化及关键影响因素 [J]. 中国抗生 素 杂 志,2021,46(04):287-290.
[13] 李冬梅,王钰宁,刘永利,等 . 唑来膦酸及其制剂的微生物学检查方法研究[J].中国现代应用药学,2017,34(07):1021-1024.
[14] 余为 . 薄膜过滤法在药品检验中的应用探讨 [J]. 世界最新医学信息文摘,2019,19(60):262.
[15] 陈洁,周剑. 盐酸小檗碱片微生物限度适用性试验验证 [J]. 现代医 药 卫 生,2017,33(12):1775-1778.
本文作者梁思华,广东大翔制药有限公司,仅供交流学习。

来源:Internet


