您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-03-20 08:48
自从1960s年代双特异性抗体概念提出,到杂交瘤技术、knobs-into-holes技术的发展,TCE已经取得了长足进步,并陆续进入市场,造福肿瘤患者。已经获批的TCE靶点包括CD3/CD20、CD3/BCMA、CD3/CD19、CD3/GPRC5D、CD3/DLL3等。典型的TCE结构是个三聚合物,由TCE、T细胞和肿瘤细胞组成,通过T细胞激活,释放炎症因子和细胞毒性分子,杀伤肿瘤细胞。考虑到TCE的免疫激活特点,首次临床起始剂量(FIH)选择通常基于MABEL(minimal anticipated biological effect level)方法。MABEL方法主要采用的体外药理学活性试验(pharmacological activity assays)终点进行计算。关于体外药理学活性试验如何影响MABEL计算起始剂量,其实是有一些细节需要考虑的,并不是随便选择一个细胞试验的结果就拿来计算起始剂量。TCE免疫激动剂属于高活性产品,起始剂量计算可能失之毫厘差之千里,过低会影响临床进度、成本和患者伦理,过高则会引入安全性风险。
可以从六个变量着手分析:1)靶细胞来源和靶点表达水平;2)效应细胞来源;3)效靶比(E:T ratio);4)孵育时间;5)试验终点选择;6)ECx.
靶细胞来源和靶点表达水平
理想的靶细胞来源是什么?是原代细胞还是细胞系?还是不同细胞来源的靶细胞均可以?理论上,患者来源的细胞/肿瘤(patient-derived cells/tumors, PDCs)比细胞系(cell lines)在靶点表达水平、肿瘤异质性和T细胞杀伤敏感性方面,与人体的相关性更强。如果采用靶点表达密度与临床不相关的细胞系进行计算,得到的剂量不一定适用于临床目标人群。但是,采用PDCs也有挑战,一是来源问题,不易获取;二是样本间的变异,尤其是实体瘤。细胞系的优势是可获得性、结果的均一性会更好。如果无法获得PDCs,不得不使用细胞系时,需谨慎选择有代表性的细胞,并考量靶点表达水平的生理相关性。
效应细胞来源
应该采用什么样的效应细胞开展TCE的体外活性研究呢?PBMC、全血、纯化的T细胞还是活化的T细胞?通常来讲,患者来源的PBMC含有更丰富的免疫细胞分类,比纯化的或活化的T细胞更合适。全血包括所有的血液成分,如果某些靶点除了膜表达,还有一定比例的可溶性占比,那么采用全血作为效应细胞,能提供更多的信息。这点我的理解是,某些膜靶点如BCMA,也会被酶或者其它方式切掉,产生一部分的游离可溶性靶点,而可溶性靶点也是可以结合TCE的。对于这类靶点,PBMC就不如全血的临床相关性更强一些。当然,采用全血作为效应细胞的方法相较于PBMC,更具挑战和难度。最理想的效应细胞应该是患者来源的效应细胞或患者肿瘤中驻留的T细胞,这类细胞代表了患者体内真正的杀伤细胞,但这类效应细胞的来源、变异面临一些挑战。另外,患者来源的PBMC虽然比健康人的效应功能更弱,但与预期临床活性却更为相关。
关于靶细胞、效应细胞选择对FIH起始剂量选择的影响,有个不错的案例。Teclistamab是一款CD3/BCMA双特异性TCE,采用MM.1R细胞系作为靶细胞,纯化的健康人T细胞作为效应细胞,效靶比为5:1,EC20作为计算依据,获得的FIH起始剂量为0.3μg/kg。这一剂量其实有些过于保守,比teclistamab后续step-up首剂量60μg/kg低了200倍。后续回顾性分析发现,如果采用PDCs作为靶细胞,起始剂量至少可以提高10倍。如果采用患者PBMC作为效应细胞,效果则会更好。毕竟健康人的PBMC本身就可能比患者效应功能更强,更何况是纯化的T细胞。
效靶比(E:T ratio)
确定了靶细胞和效应细胞,接下来的问题便是应该设置什么样的效靶比最为合适。效应细胞:靶细胞的比例越高,比如3:1、5:1、10:1,会影响EC50或EC20值,过高估计待测产品的活性,导致更低的起始剂量。并不是每个适应症对应一个统一的效靶比,毕竟每个患者的免疫状态和靶负荷不同。临床比较常见的一个场景是患者经过标准治疗(以化疗居多)后,免疫细胞大幅降低,之后肿瘤进展,肿瘤负荷增加,形成的局面是效靶比明显降低。另外,对于免疫细胞浸润比较少的冷肿瘤,效靶比也很低。来自Genentech的Michael Z. Liao等人(2020),评估过一款治疗胃癌的TCE产品,10:1和1:5的效靶比相比,获得的FIH起始剂量低10倍。
解决效靶比的其中一个路径是采用患者的肿瘤样本进行效靶比检测,根据真实的效靶比情况设计体外活性试验方案。如果拿不到患者样本,可以查询有没有公开文献报道。
通常来讲,血液瘤的效靶比较实体瘤更高,前者可以考虑1:1,后者则可以考虑1:5或者1:10,预期与临床相关性更好。当然,前提是1:1的效靶比在体外试验中能观察到功能信号,即对设置的终点有响应。如果因效靶比太低,导致剂量-反应关系不明显,可以借助定量系统药理学(QSP)模型辅助进行剂量-反应关系预测。
孵育时间
靶细胞和效应细胞的孵育时间决定了反应是否达到了Emax,即最大效应。时间点设置因TCE分子设计、靶点等而异。孵育时间过久会导致人为误差,过度高估产品活性,影响起始剂量设计。可以通过表征不同时间点的活性,进行动态评估,找到Tmax(time to max effect)。如果采用细胞因子作为体外试验的终点指标,考虑到细胞因子随时间延长,分泌增加,且体内-体外相关性尚不完全清楚。故,通常建议细胞因子的检测,取早期时间点如24h或48h更合适一些。
试验终点选择
TCE常见的体外活性终点包括T细胞激活(CD69+、CD25+)、细胞毒性、细胞因子释放等。哪个终点用于MABEL计算相关性更好?如果T细胞激活或者细胞毒性作为最敏感的终点还好,倒没有太多讲究。唯一需要提醒的是,如果效靶比太低,以细胞毒性作为试验终点,剂量-反应关系的获得可能是个挑战。CD25和CD69的区别是,CD69作为T细胞激活的early marker,用于测定给予起始剂量后的early activity,相关性更好。
如果采用细胞因子作为终点指标,却是有一些注意事项需要考虑。细胞因子是白介素、干扰素、肿瘤坏死因子等一系列小分子蛋白质或多肽的混合物。其中IL-6和其他促炎因子(如IL-1b)与CRS机制最为相关。选择细胞因子作为试验终点的挑战性体现在两点,一是受不同donor个体间的高变异影响,二是细胞因子是一组组合物,单一细胞因子的意义有限,最好能看到关键细胞因子的共同升高,如TNF-α、IFN-γ、GM-CSF、IL-1、IL-6。比如CD3/GPRC5D双抗talquetamab,发现IL-10是最敏感的试验终点,EC20为0.032nM。考虑到其他细胞因子的升高水平不如IL-10那么敏感,且个体间变异很大,最后选择了T细胞激活标志物CD25作为起始剂量计算依据,较IL-10计算的剂量高2.5倍。CD3/CD20双抗odronextamab则不同,本品体外活性观察到TNF-α、IFN-γ、IL-6均升高,且EC50介于0.3-0.5nM,敏感度类似。
ECx
所谓ECx,是指选择EC20、EC30还是EC50作为计算依据。毫无疑问,EC20、EC30获得的剂量会更为安全,同时也意味着比较保守。大部分TCE,采用EC50获得的起始剂量是可以接受的。来自合适的体外药理学试验数据,FDA也同意采用EC50进行MABEL计算。当然,对于全新靶点,且有off-tumor表达,可以考虑采用更保守的EC20、EC30,其他情况可以考虑以EC50进行计算。
案例
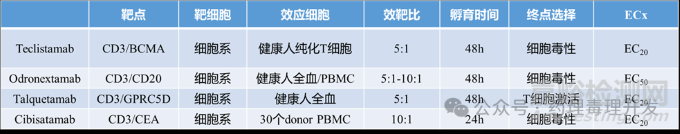
下表罗列了4个TCE双抗的MABEL法计算FIH起始剂量的体外药理试验特点。Teclistamab靶细胞除了细胞系,也采用了PDCs,且基于PDCs获得的剂量与step-up剂量更为接近。可能出于安全性考虑,最终选择的更保守的细胞系来源的数据。效应细胞来源方面,健康人血样可获得性更强,用的最多。另外,效靶比偏高,5:1、10:1为主。孵育时间介于24-48h。试验终点细胞毒性、T细胞激活均可。Odronextamab也采用了细胞因子TNF-α、IFN-γ、IL-6进行了计算,且能得到更高,相关性更好的起始剂量。不过,很明显,大多数TCE产品选择了更为保守的策略。相信随着TCE研究数据的积累,MABEL计算FIH起始剂量会更科学、更理性。

来源:药理毒理开发


