您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-04 08:23
导语:专利的重要性毋容置疑,对于开发周期的医疗器械的重要性更是至关重要。现代研发工程师应了解专利规则,具备专利保护意识,并在IPR或外部咨询师的协助下具备专利检索利用、专利侵权分析、专利规避设计和专利布局与保护的能力。而至关重要的专利保护能力离不开专利挖掘,帮助我们挖掘对应的专利,以申请相应的专利。本文结合医疗器械设计开发的流程介绍在各阶段可以进行的专利保护工作。
第一部分:立项和策划阶段
在立项和策划阶段一般都需要进行可行性分析,一般可行性分析应包括:市场可行性分析(拟开发产品国内外需求情况);技术调研(国内外该类技术发展水平和趋势、当前同类产品的技术特点和优缺点、可获得的现有技术资源、产品开发的技术难点、拟开发产品的创新点)、技术可行性分析(现有同类产品的临床情况、拟采用设计方案、前期研究基础等)、经济可行性分析(评价实施项目的经济目标和经济效益等)、注册策略分析、专利检索分析等。
结合同类产品的技术特点和优缺点,基本可以输出我们需要解决的技术问题——拟解决的技术问题。对于某些成熟的产品,也可以回答出了产品的组件或配方,以及共性组件,甚至组件之间的连接方式或如何实现其连接。
同时搜索国内外专利,特别是目标市场对于同类产品和同类设计的专利,识别可能的风险,并寻求降低风险的方法,并形成相应的文件,作为可行性分析的附件。
因此,在该阶段需要进行专利检索分析,同时策划产品未来上市市场,规划专利布局的国家或地区。
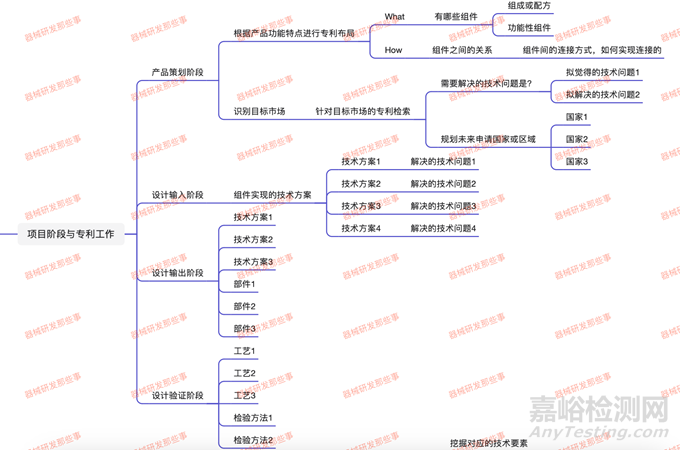
第二部分:设计输入阶段
设计输入阶段,基于前期拆解的拟解决的技术问题,在该阶段除了进行用户需求、识别适用的法规标准、安全特征问题清单、危险(源)分析和产品规范等。其中最重要的设计输入的信息来源包含:根据预期用途规定的功能、性能、可用性和安全性要求;适用的法规要求和标准;适用的风险管理的输出;适用的以前类似设计提供的信息;产品和过程的设计开发所必需的其它要求。将以上信息转变成用工程语言描述的产品需求,输出“产品规范”。应至少包括:产品预期用途、性能要求(物理性能、化学性能等指标和确定依据)、患者要求(适应症、禁忌症和适应人群)、使用者要求、物理特性(产品规格尺寸及公差要求、外观要求等)、可用性要求、安全性要求(毒性和生物相容性要求等)、MRI兼容性要求、灭菌要求、货架寿命要求、包装与标识要求、产品贮存与运输要求、类似产品的不良事件/投诉、来源于以前类似的设计信息(适用时)、与附件或辅助器械的兼容性要求、预期使用环境的相容性要求、使用者的培训要求、适用的法律法规和标准要求等。
我们可以看到其实在用户需求输入的时候对于产品的功能其实已经进行了定义,同时对产品预期或期待的需求已进入了输入,相当于回答了相对于现有技术特点本产品的优势有哪些,也就相当于回答了专利当中的技术效果。因此,在该阶段,我们应该输入对应的技术方案。对于一些结构性产品,如果产品是比较创新的,在此阶段建议申请一些专利,首先保护产品的功能性特征。当然这对于产品的创新性有很高的要求。如果不是首创产品,也可以在此阶段输入一系列解决技术的问题的技术方案。
第三部分:设计输出阶段
设计输入阶段,基于前一阶段输入的技术方案,在该阶段即可输出对应的技术方案,然后申请专利了。这个阶段可以申请许多关于产品设计的专利以及检验方法的专利。
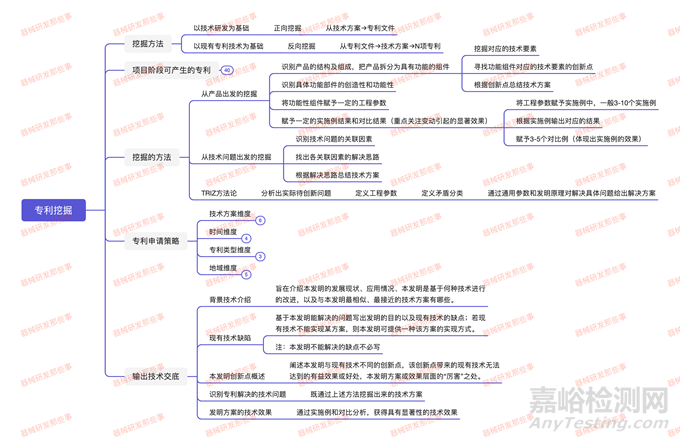
在此特别强调专利挖掘的方法:

从产品出发的挖掘:
1-识别产品的结构及组成,把产品拆分为具有功能的组件
挖掘对应的技术要素
寻找功能组件对应的技术要素的创新点
根据创新点总结技术方案
2-识别具体功能部件的创造性和功能性
3-将功能性组件赋予一定的工程参数
4-赋予一定的实施例结果和对比结果(重点关注变动引起的显著效果)
将工程参数赋予实施例中,一般3-10个实施例
根据实施例输出对应的结果
赋予3-5个对比例(体现出实施例的效果)
从技术问题出发的挖掘:
识别技术问题的关联因素
找出各关联因素的解决思路
根据解决思路总结技术方案
第四部分:设计验证阶段
这一阶段更多的是针对产品的验证,以确认产品的设计满足设计输入的要求。该阶段进行的活动包括但不限于过程确认、注册检验、物理和化学性能研究、稳定性研究、生物学评价、动物试验研究、中间品防护与存储要求、工具型耗材设计与输出、艺残留物分析与限量验证、过程能力研究、材料评价、设计确认策划、临床试验策划等。因此可以看出,一方面我们会对产品的性能进行确认,这一阶段会产品大量的数据。同时经过了设计输出阶段,产品已经设计定型,在前期进行了大量的设计更改。这些设计更改都是很好的专利素材(懂的都懂)。在这一阶段可以形成的专利,包括工艺和检验方法,以及设计变更更有技术方案。当然,一般工艺是不便于申请专利的,你懂的。
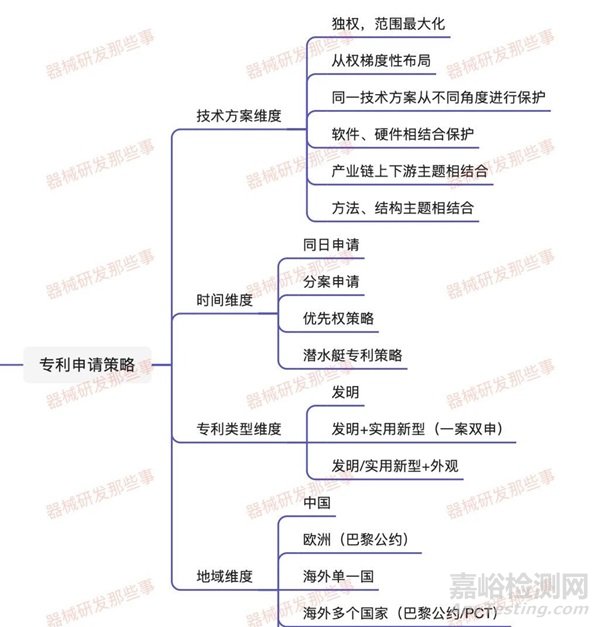
第五部分:专利申请策略

来源:器械研发那些事