您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2024-07-17 20:33
恒瑞的警告信还是来了,一哥在生产质控上这次栽了跟头。
时隔一个月后,FDA官网公布了向“医药一哥”发布的警告信,从公开信息来看,此次收到的警告信与6月初公司收到的483表格为同一个关联事件,并没有显示FDA向恒瑞下发了进口禁令。
▍FDA现场检查收到警告信意味着什么
此前6月恒瑞已经收到FORM 483表格,进入现场检查的第二阶段,OAI(Official Action Indicated)阶段。此次警告信则意味着上一阶段的整改并没有全部得到FDA认可,进入更严肃监管的正式行动阶段。
上一阶段,恒瑞收到OAI意味着此次检查已经严重阶段,需要引起公司足够重视。而近日收到警告信,对于医药制造现场检查来说,这个已经是极度严重的事件了。
从整个FDA检查流程来看,恒瑞此次现场检查已经进入最后一个阶段,如果15日内提交的整改意见获得通过,警告信将关闭;如果不能获得FDA通过,则意味着将有召回和出口禁令等更严重后果。
但目前,恒瑞向外界表示:公司该场地的产品出口未受影响,本次警告信对公司其他生产场地无影响,目前公司出口美国的产品也未受影响。
▍FDA发现什么违规事项
此次警告信的核心内容集中在两点,虽然不是直接影响产品质量安全,但无菌区域防污染不到位的风险仍不可小觑。
1)质量控制部门在文档的监督和控制方面的履职不够,未能确保生产的制剂符合CGMP要求;
2)设施设计不充分,用于生产无菌产品的区域没有足够的防止污染或混淆的措施。
从目前公开信息来看,此次警告信所提出的缺陷与此前的483表所列问题基本一致,没有影响到药品质量安全,恒瑞医药也没有收到FDA进口禁令,说明FDA目前并未对产品质量有明确担忧。
据公开信息显示,恒瑞医药在全国有9个城市建有生产基地,仅连云港就有国际化制剂生产基地、新医药产业园、生物医药生产基地、原料药生产基地四个生产基地。据了解,此次警告信涉及场地出口美国的主要为一些仿制药制剂产品,目前共12个仿制药品种获FDA上市许可,但都不是公司主要产品。该场地2023年出口美国市场的收入仅占恒瑞当年营业收入的0.39%,2024年一季度出口美国市场的收入仅占恒瑞当期营业收入的0.47%。
▍是“一哥”突然松懈了?还是另有原因
从恒瑞医药官网可查询到,恒瑞首次向美国出口制剂产品是在2011年,抗肿瘤药伊立替康注射液获准在美国上市,公司成为第一家注射剂获准在美上市的民族制药企业。加上今年获批的他克莫司和布比卡因,至今恒瑞已有近20款仿制药进入美国市场,目前恒瑞产品已进入超40个国家,可谓出口经验丰富。
2022年年报显示:2019年,公司作为国内首家接受美国FDA总部PV系统视察的公司,在视察文件方面做到文件100%准备妥当、100%质量审阅,在系统流程方面做到FDA法规均有相应流程体现、流程执行均有文档可呈现,成为国内首家顺利通过美国FDA总部PV 系统视察、现场核查的公司。
由上可见其历史上在质量把控、合规管理等方面做得相当不错了。那么,以往FDA多次检查都顺利过关,这次突然收到警告信,是恒瑞方面突然松懈了,还是另有原因?
来看看下面这组数据,指向性已经相当明显。
根据FDA官方公布2019年-2024年合规行动措施(生物制品,医疗器械,人用药品)统计显示,FDA在2024年已经密集发布了134封警告信,呈现大幅增加的趋势。
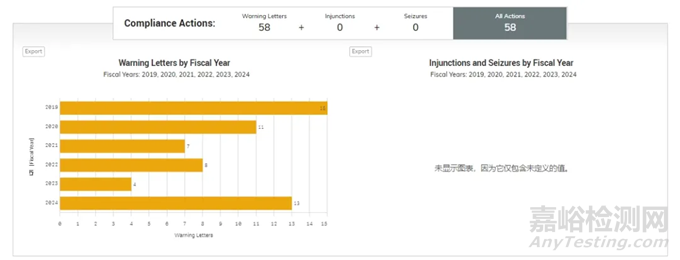
2019-2024财年FDA向中国企业发布警告信汇总
从这张图可以看到,2024财年过去了9个月(2023年10月至2024年6月),中国企业警告信(13封)的数量已经远远超过了2023年全年。
与此同时,该合规行动措施显示,按照检查次数统计,美国、印度、中国分别为:10901、933、282,警告信出具比例分别为6.62%、7.07%、20.56%;美国的检查结果OAI(Official Action Indicated,强制采取整改,是FDA工厂审查的直接结果之一)比例5.72%,大致与警告信比例相同,而中国和印度OAI比例大致相同的情况下(中国、印度分别为9.75%、11.35%),FDA给中国企业的警告信比例却远远高于美国和印度。由此可以看出,FDA对中国和印度企业的监管和行动措施中对中国企业的容忍度更低。
创新药进入美国市场本就困难重重,但没想到如今仿制药挤进美国市场的这条路也更加艰难。
其实纵览全局进一步分析,美国的种种举动,似乎是对中国整个生物医药产业在美业务的发难。
今年5月,美国立法机构修改了《生物安全法案》,要求美国公司在2032年之前结束与药明康德等中国公司的合作,5月15日,美国众议院监督和问责委员会以压倒性票数批准了《生物安全法案》。虽然有消息称《生物安全法案》并没能纳入《国防授权法案》(NDAA)这个立法快速通道,但很多分析师认为该法案仍可能以其他方式通过。
更耐人寻味的是,6月6日,韩国、印度、美国、日本和欧盟正式发起成立了旨在合作建立有韧性供应链的“生物制药联盟”。此时,距离FDA公布恒瑞收到483表格仅过去了两天的时间。有媒体分析称,当下该联盟范围几乎已包含了国际上的主流市场。以美、日、欧盟为代表的全球创新药研发第一梯队,以三星生物等为代表的韩国CXO企业,再加上供应了美国60%以上过专利期仿制药的印度。“高、中、低端产品、原料药与供应链都聚齐了”。五方“合纵连横”,或许只为给中国生物医药产业的出海垒起一座不可逾越的城墙。
结合多种动向,恒瑞与FDA的此番博弈,也许已经不能仅作为个例来看了。
(汇编自:华尔街见闻、医药魔方)

来源:Internet


