您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-09-21 10:45
Ni-NTA是镍柱纯化常用的一种填料,镍柱纯化常指亲和层析,该方法利用组氨酸(His)残基上的咪唑基团与Ni2+之间能形成配位键的特性,实现对含有His-Tag(组氨酸标签)的目的蛋白的特异性吸附。

His-Tag是重组蛋白纯化中最常见的标签之一,其通过融合表达与目的蛋白相连,从而赋予目的蛋白与镍柱结合的能力。在层析过程中,杂蛋白因不带有His残基无法与Ni2+结合,从而实现了目的蛋白与非目的蛋白的有效分离。
操作步骤
① 准备工作:
(1)根据目的蛋白的性质,选择合适的镍柱类型和洗脱方式,配制合适PH值的缓冲液和洗脱液。
(2)缓冲液和洗脱液在蛋白纯化操作前用0.45 μm或0.22 μm滤头过滤除菌避免污染镍柱,减少寿命。
② 样品预处理:
预处理待纯化的蛋白样品,如离心去除杂质、调整样品的pH值、低浓度咪唑溶液透析以去除培养基中的EDTA和盐溶液等(具体操作需根据蛋白性质设计)。
③ 镍柱平衡及上样:
利用无咪唑或低浓度咪唑的缓冲液对镍柱进行平衡,待曲线维稳10 min左右,即平衡结束。平衡完成后,将处理完毕的样品缓慢且匀速地加入镍柱中,使目的蛋白与镍柱充分结合。
④ 除杂:
使用低浓度咪唑缓冲液(如2、5 、10、20、25 mM咪唑)冲洗镍柱,去除与镍柱非特异性结合的杂蛋白。该过程应合理控制流速和时间,以确保杂蛋白被完全去除。
⑤ 洗脱:
为收集高纯度的目的蛋白,使用含有高浓度咪唑的洗脱液将目的蛋白从镍柱上洗脱下来。通过梯度洗脱的方式,逐步增加洗脱液中咪唑的浓度(如50、100、200、300、400、500 mM咪唑)。在目的蛋白首次纯化实验中,应设置多个从低至高咪唑浓度的缓冲液,探索合适的洗脱条件。
⑥ 收集与分析:
收集含目的蛋白的洗脱液样品,利用SDS-PAGE电泳等方法对其进行分析以评估其纯度和浓度。
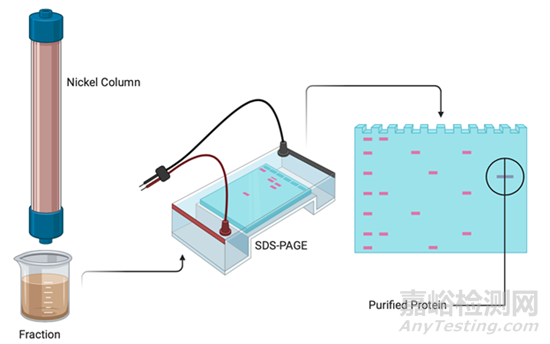
⑦ 清洗与保存:
使用ddH2O冲洗镍柱,并用20%乙醇溶液冲洗并保存镍柱以防止微生物生长。
注意事项
① 在实验前查询并了解目的蛋白的性质(分子量、等电点、氨基酸组成、聚体等),并严格控制实验条件,如缓冲液的pH值和咪唑浓度,以确保实验的准确性和可重复性。
② 严格按照说明书操作,并且样品在上柱前需要进行预处理(高速离心、调PH或透析等),以保护镍柱,避免污染和损伤。
③ 在镍柱的使用中,应避免缓冲液中存在还原剂和螯合剂,以免 Ni2+ 被还原而脱落。
④ 镍柱使用太久或脱镍,可进行镍柱再生或更换新的镍柱。
⑤ 尽量收集镍柱纯化过程中每一步产生的洗脱液,以便实验结束后利用SDS-PAGE等方法对蛋白纯化过程进行进一步分析。

来源:实验老司机


