您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-11-16 16:28
摘 要 / Abstract
随着科技的迅猛发展,我国临床研究正处于数字化转型的关键阶段,数字化技术为临床研究提供了更高效的方式。然而,作为保障研究参与者权益的核心环节,知情同意的数字化进程相对滞后,目前缺乏明确的法律法规和伦理框架来规范电子知情同意(eIC)的发展。本文通过回顾现有文献,分析eIC 相较于传统纸质知情同意的优势,总结其现有的实践成果,并探讨在应用过程中面临的挑战,以期为eIC 系统的构建提供概念框架和理论支持。
China's clinical research is undergoing a crucial phase of digital transformation driven by rapid advancements in science and technology. Digital technology offers a more efficient approach to conducting clinical research. Nevertheless, the digitization of informed consent, a crucial component in protecting participant rights, has lagged behind. Currently, there is a shortage of clear legal regulations and ethical frameworks governing the advancement of electronic informed consent (eIC). By reviewing existing literature, this paper examines the benefits of eIC compared to traditional paper-based informed consent, summarizes its current practical accomplishments, and investigates the challenges faced during its implementation. This study aims to establish a conceptual framework and theoretical basis for the future development of an eIC system.
关 键 词 / Key words
临床研究;数字化转型;电子知情同意;真实世界数据;去中心化临床试验
clinical research; digital transformation; electronic informed consent; real-world data; decentralized clinical trial
1、临床研究的数字化转型
随着互联网技术的发展和科技的不断革新,临床研究经历了从电子化、信息化到数字化的发展阶段,数字技术对临床研究产生了深远影响[1-2]。目前,对于临床研究数字化尚无明确的定义,但是主流观点认为,临床研究数字化转型是通过数字化技术的应用,如互联网和社交媒体、可穿戴设备、大数据、人工智能等,提高整个研究的效率,为临床研究的成功开展提供保障[2-4]。
传统的临床研究较为显著的两个特点是纸质数据采集和依赖实体研究机构才能够成功进行[1]。随着数字化的发展,数据采集可以依赖电子化的方式,目前已有研究团队在数据的完整性方面进行了深入研究和探讨,构建了真实世界数据(real-world data,RWD)采集、治理与管理一体化工具[3],促进临床研究数字化的进一步发展。新冠疫情暴发后,去中心化临床试验(decentralized clinical trials,DCT)快速发展,成为临床研究数字化的典型代表,可以通过远程医疗和数字健康技术进行相关的临床试验,其实施依赖于数字健康技术[5],能够有效降低疫情的传播风险[6]。同时,数字健康技术的应用推动产生了大量数据,也推进了真实世界研究(real-world study,RWS)的发展, 数字化转型与RWD和真实世界证据(real-world evidence,RWE) 互相交错、密不可分,成为推动医疗健康技术发展的重要因素。高质量的RWE 可以补充传统随机对照试验的不足,使临床研究更加完善[7]。
2023 年印发的《涉及人的生命科学和医学研究伦理审查办法》规定, 研究者开展研究前,应当获得研究参与者自愿签署的知情同意书,并且知情同意书应当包含充分、完整、准确的信息, 为使研究参与者充分理解,可以采用视频图像等进行表述[8]。然而,一项2022 年由美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)开展的电子知情同意(electronic informed consent,eIC)调查结果显示,大多数(16/25,占比64%)临床研究中知情同意的方式完全依靠纸质[9],这说明知情同意仍主要通过面对面的方式交谈,并进行纸质知情同意书的签署。《医疗卫生机构开展研究者发起的临床研究管理办法》规定,医疗卫生机构开展临床研究应尊重研究参与者的知情权与自主选择权,并且要遵守相关技术准则和伦理规范的要求[10]。鉴于数字化发展使临床研究的复杂度日益增加,传统的知情同意方式已经越来越不能适应新的研究模式,并对整个临床研究的质量以及研究参与者的依从性、理解程度等方面提出挑战[11]。因此,应当寻求新的方法促进知情同意向电子化发展,这是临床研究数字化转型过程中的重要一环。
近年来,eIC的应用与发展是临床研究数字化过程中研究参与者权益保护的重点内容。eIC是使用电子系统和程序,包括使用多种电子媒体,如文本、图像、音频、视频、播客、互动网站、生物识别设备和读卡器等,传达研究相关信息,并获取和记录知情同意的过程[12]。常规的纸质知情同意方式对于DCT、RWS 等涉及数字化的临床研究而言难以持续实施,因为相关研究参与者若此时不在或已经离开研究中心,就几乎不可能回到研究中心签署相关知情同意。因此,与传统纸质知情同意相比,eIC具有比较明显的优势,不受时空限制,可通过增加与研究参与者的互动,增强文本的可读性,提高研究参与者的理解程度,简化临床研究的整体流程,提升临床研究的效率,为整个临床研究降本增效,推动各类临床研究进一步发展。
在临床研究数字化转型过程中, 我国在新冠疫情期间针对eIC的应用与推广推出了相关法律政策,但尚缺少完整的梳理和全面的总结。中南大学湘雅医院曾开展的一项横断面研究显示,大多数研究人员认为eIC的挑战在于其信息的安全性和保密性,以及对研究参与者的权益影响[13]。因此,为弥补这一方面研究的空白,本文对eIC进行深入归纳,关注近些年来eIC在临床研究数字化转型当中的进展。同时,比较研究eIC与传统知情同意过程的优缺点,通过文献梳理分析eIC实施过程中面临的挑战,并提出相关建议,以期为后续eIC平台构建提供理论支持,充分挖掘数字技术潜能,推动临床研究数字化的进一步发展。
2、电子知情同意的应用过程
2013 年,印度药典委员会(Indian Pharmacopoeia Commission)首次建议以音频或视频的方式进行知情同意过程的收集。同年, 该提议被正式纳入《印度公报》(India Notification)作为规则草案的一部分,该草案指出,在进行临床试验的过程中,研究者应制作并保存研究参与者知情同意过程的视频记录,此记录应涵盖向研究参与者传达信息的全过程以及确保研究参与者充分知情并理解所接收信息的环节[14]。2016年,国际医学科学组织理事会(Council for International Organizations of Medical Sciences,CIOMS)和世界卫生组织(World Health Organization,WHO)共同颁布《涉及人的健康相关研究国际伦理准则》(International Ethical Guidelines for Health-Related Research Involving Humans)[15],其中第十二条准则明确聚焦临床研究领域的数据收集、存储与使用的伦理规范, 推动临床研究数字化转型进一步发展。该准则强调, 任何涉及数据存储的机构均须构建并实施一套严谨的管理体系, 以确保所有数据的利用均基于合法授权, 且绝不侵犯研究参与者的合法权益。对于出于研究目的而进行的数据收集与存储活动,必须事先获得研究参与者的明确知情同意,或依据广泛性知情同意(以下简称泛知情同情)的原则进行,以充分尊重并保护研究参与者的隐私与自主。2016 年, 美国食品药品监督管理局(Food and Drug Administration,FDA) 与美国卫生与公众服务部(Department of Health and Human Services,HHS) 联合发布《使用eIC的问题与解答:面向机构审查委员会、研究人员及赞助商的指南》(Use of Electronic Informed Consent in Clinical Investigations-Questions and Answers: Guidance for Institutional Review Boards, Investigators, and Sponsors)[12]。该指南是全球首份针对eIC的官方指导文件,详尽阐述了申办方、研究者及机构审查伦理委员会在eIC应用过程中应当负责的具体职责和规范。其核心目标在于增进研究参与者对eIC过程的理解与信任,同时确保eIC实施过程中个人隐私的严格保护及数据安全,为临床研究领域的数字化转型树立了新的伦理与技术标杆。2021 年3 月, 为了进一步推动eIC在临床试验中的规范应用,欧洲合同研究组织联合会(European CRO Federation,EUCROF) 携手电子医疗论坛(eClinical Forum) 共同发布了《电子知情同意实施指南与实践考虑》(Electronic Informed Consent Implementation Guide Practical Considerations)[16]。该指南深入探讨了eIC实施过程中需要注意的关键事项,旨在确保eIC提高研究效率的同时,严格遵循数据隐私保护原则及相关伦理法规。该指南通过提供详尽的实践指导和建议,为申办方、研究者及伦理审查机构等各方提供了宝贵的参考, 旨在共同促进eIC在临床研究中的安全、有效与合规应用。2022 年,面对全球新冠疫情的持续挑战,欧洲药品管理局(European Medicines Agency,EMA)及时响应,颁布并更新了《COVID-19( 新型冠状病毒)大流行期间临床试验管理指南》[Guidance on the Management of Clinical Trials During the COVID-19 (Coronavirus) Pandemic][17]。该指南特别强调了在这一特殊时期,如何有效利用eIC并加速推进其应用与发展。该指南不仅为新冠疫情防控背景下临床研究的顺利进行提供了指导, 还明确了eIC在简化流程、提高参与率、确保研究参与者安全及隐私保护等方面的优势,助力科研界更加高效地应对新冠疫情,加速药物与治疗方案的研发进程。2024 年9 月, 美国FDA 正式发布《开展去中心化临床试验指南》(Conducting Clinical Trials With Decentralized Elements),为相关利益者提供一定的指导并回答相关问题[18]。国外临床研究eIC发展过程见图1。
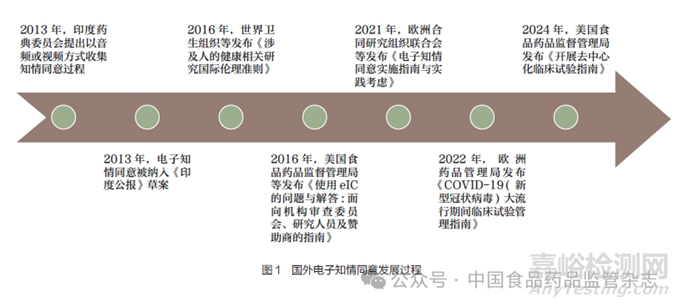
2020 年,为积极应对新冠疫情带来的挑战,我国国家药品监督管理局适时发布了《新冠肺炎疫情期间药物临床试验管理指导原则(试行)》[19]。该指导原则明确提出了发展DCT 的构想,旨在通过创新模式优化新冠疫情期间的临床试验流程。具体而言,该指导原则鼓励在新冠疫情防控的特殊时期,开展药物临床试验时积极采用远程监查及eIC等先进的数字化技术手段,以提高试验效率,降低人员聚集风险,并确保研究参与者的安全与健康。这一举措不仅体现了我国在药物研发领域的快速响应与创新能力,也为全球临床试验管理提供了有益的借鉴与参考。2022 年发布的《罕见疾病药物临床研发技术指导原则》提出,针对这类发病率或患病率极低的罕见病,在结合疾病特点的基础上,应该适当采用更加灵活的试验设计方式,鼓励建立患者登记系统,采用eIC等数字化工具,可以更加便捷地获取患者对其数据使用及管理的同意[20],但对具体过程与内容未做相关规定。尽管eIC在我国展现出了巨大的发展潜力,并已开始逐步应用于临床试验中,但总体而言,其仍处于起步发展的初级阶段。当前,我国在eIC领域尚缺乏全面、系统的法律法规体系来进行有效的监管与指导,这在一定程度上限制了其进一步的发展与普及。因此,建立健全相关法律法规,明确eIC的法律地位、操作规范及监管要求,已成为推动我国eIC健康有序发展的关键所在。
3、临床研究数字化场景下电子知情同意的优势
研究参与者保护是临床研究中伦理审查的重点。部分研究者在设计研究方案时经常混淆知情同意的概念。知情同意是一个过程, 而不单单指进行知情同意书的签署。《贝尔蒙报告》(The Belmont Report)指出,知情同意应包括3 个要素,即信息、理解和自愿,在研究人员告知研究的全部信息后,研究参与者有权自愿在研究的任意时刻授权是否参加和继续进行试验[21]。随着相关法律法规的完善,知情同意书有越来越冗长复杂的趋势,对研究参与者充分理解研究信息造成了客观障碍[22],极有可能出现因研究参与者没有全面理解研究内容等,导致其中途退出研究的情况,最终耗费研究人员的精力,损害研究参与者的权利和安全。eIC可以采用数字化的方式,实行动态的知情同意过程,保留知情的选择退出程序,充分传递研究信息以及获取和记录知情同意过程,从而优化研究人员和研究参与者的整体体验。同时,伴随着数字化转型, 以及越来越多DCT、RWS 等的开展,eIC的重要价值日益凸显。在一项横断面研究中,超过一半(51.2%)的研究参与者认为eIC可以完全取代传统的纸质知情同意方式[13]。传统知情同意过程与eIC流程的对比具体见表1。

3.1 研究参与者的理解度
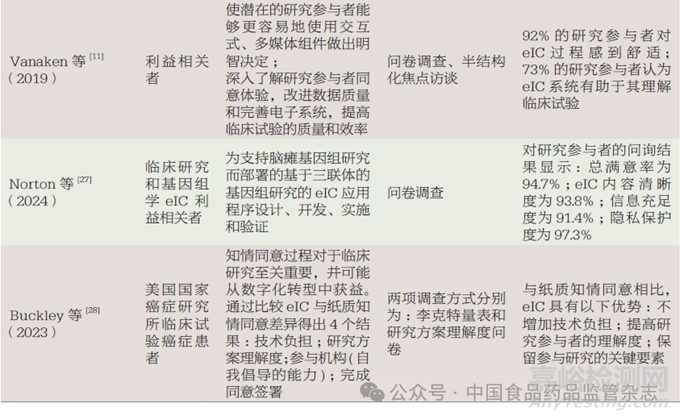
为提高研究参与者的理解度,传统的知情同意往往会增加知情同意书的内容与长度,但这也增加了知情同意过程的复杂性,并且无法了解研究参与者在签署时是否真正理解整个研究的目的、内容及带来的获益和风险,这给临床研究的下一步开展带来了很多问题。eIC能够通过视频、图像、音频、交互理解问题和头像(虚拟角色)等多媒体互动形式,支持参与同意的界面,实质性增强研究参与者的可阅读性,提高研究参与者的理解度,更快地帮助研究参与者决定是否参与研究过程[23],从而提高临床研究的整体参与度,同时减少因未理解研究内容而造成的研究参与者拒绝入组的情况[24-25]。关于研究参与者理解度的文献信息见表2。

3.2 签署及保存
与纸质知情同意相比,eIC不受空间限制,研究参与者不需要来到临床研究的试验地点,可以直接在线上签署知情同意,且签名方式多样,可以用鼠标、手写笔或手指等进行签署[23],从而有效简化研究参与者参与临床研究的过程,增加其试验的可得性。Cragg 等[29] 提出研究参与者可以突破空间限制签署知情同意,提高临床研究的招募和参与率,有效抵抗外部因素冲击(如新冠疫情对临床研究的影响)。De Sutter 等[30] 提出eIC可以进行个性化的eIC界面设置,提供多样的签署方式,更好地适应和满足研究者和研究参与者的需求。Cohen 等[31] 在其研究中提到,eIC可以通过电子签名捕获的方式进行签署。传统的知情同意通过纸质形式保存,极易发生丢失或污损。而eIC可以将知情同意过程的文档记录在应用程序中,确保易读性和记录的完整性,满足远程访问的需要,使研究者和研究参与者共同受益[9]。eIC在签署完成后可以特定的PDF 形式储存在临床研究项目的文本库中,研究参与者在完成签署前将接受关于再次确认相关信息的问询,以确保信息的准确性[12]。
3.3 动态知情
在临床研究中,知情同意并非是一个一次性事件,即不是签署后就完成了知情同意,而是一个持续的过程,贯穿整个研究过程始终[23]。因此,当研究过程中有新的内容更新时,应及时通知研究参与者,并再次获取其同意,如果更新的内容未能获取研究参与者的再次同意,或是研究参与者单纯想要退出研究,可以选择撤回知情同意并退出临床研究。需要注意的是,临床研究的数字化转型也带来了隐私安全问题。在收集数据的同时,研究参与者作为数据主体,同时也享有对其数据的控制权,即选择退出权[32]。传统的知情同意方式并不能及时通知研究参与者研究信息的变化,并且需要研究参与者多次前往研究中心进行同意的再次授予,同时研究参与者往往不知道有选择退出这一选项,使其权利受到一定的损害。eIC的发展可以弥补这一缺陷,在研究开始前签署知情同意时,明确告知研究参与者拥有退出权利,在研究过程中,如果研究参与者想要撤回其知情同意,可以使用选择退出程序,一键撤回其去标识化的数据并退出研究。De Sutter 等[30] 发现,在长期的临床研究中,研究参与者希望获得研究的更新信息以及进展情况,此时可以通过电子邮件等方式进行通知,以获取研究参与者的再次同意。Leeming 等[33]在一项规模较大的儿童队列研究中提出,幼儿的知情同意过程并非贯穿其一生,监护人有权在幼儿情况发生变化时撤回知情同意,eIC的使用极大提高了整个研究的效率。
4、电子知情同意发展面临的挑战
4.1 eIC的签署形式及如何确定自愿参与
目前,我国知情同意签署仍主要采用传统纸质版、面对面手写的签署形式[34]。《电子签名法》明确规定了电子签名的具体条款,并确立其法律效力,但目前我国尚无关于约束eIC在临床研究数字化过程中使用的明确规定。需要注意的是,远程eIC难以对知情同意者进行身份核实,若要确保远程同意是自愿的,不受不正当的影响或胁迫,则存在一定的操作难度[35]。
4.2 弱势群体应用
目前,我国医疗卫生资源配置仍不均衡,绝大多数临床研究集中在大城市,基层医疗机构鲜有开展临床研究。基层医疗机构受技术、设备等因素的影响往往难以推广eIC,且难以招募偏远地区的研究参与者。尤其是对于老年人、残疾人等特殊群体研究参与者,电子产品的应用难度较高、接受度较低。对于儿童患者、精神疾病患者等弱势群体,通常由其法定监护人进行知情而忽略其本人意愿,而在应用eIC时,研究参与者可以不用到场就进行知情同意,这就更加难以确保是否由其本人在充分知情的前提下自愿、自主地作出同意,并且在应用eIC的过程中,可能会存在过度劝诱的现象[36-37]。因此,eIC的应用可能会放大潜在的不平等现象,使弱势群体受到不公正的待遇,也增加了临床研究的偏倚风险。
4.3 隐私保护及信息安全问题
eIC通过使用数字工具和数据基础设施来支持临床研究数字化转型,这样的方式可能会增加网络安全的风险[38]。虽然传统纸质知情同意也存在文件丢失等问题,但其签署形式一般是手动书写,当采用面部识别等生物识别技术时,在缺乏数据储存、访问权限等相关政策的情况下,可能导致数据泄露,损害研究参与者的个人隐私[39]。目前,医院信息系统与临床研究eIC系统的对接尚无可遵照的法规,涉及eIC隐私保护的相关伦理法规也有待出台[35]。为了更好地保护研究参与者的隐私权利,相关研究应当尽可能对数据进行去标识化或匿名化处理。如果在研究过程中不得不使用可标识化的数据,研究者和申办方需要给出合理的说明和解释。
4.4 缺少技术性支持
目前,eIC平台建设尚无实践标准,相关供应商只能孤立开发eIC平台,同时,大多数供应商的软件能力有限,容易出现设备问题[9]。因此,目前没有一个完整的平台支持知情同意上线。《个人信息保护法》规定,基于个人同意处理个人信息的,个人有权撤回其同意。个人信息处理者应当提供便捷的撤回同意的方式。例如,对于RWD 的使用,研究参与者如果有任何异议,都有权利在任意时刻撤回数据库使用他们数据的同意,且不承担任何损失或者责任。同意撤回,应由研究参与者签署文件而生效,相关数据可以归还研究参与者或销毁,当撤回对研究的知情后,这些数据将不再被允许应用于未来的研究中[27]。若缺少这一步骤,研究参与者参与临床研究的知情选择退出权可能会受到损害。
5、展 望
当前,我国eIC的发展正处于起步阶段,充满着无限的可能性和潜力。随着数字化转型和不断创新,eIC将进一步提高临床研究的效率和质量,提升研究参与者的理解度,优化整个研究流程。笔者认为,以下eIC研究方向值得相关研究人员关注。
5.1 纸质与电子知情同意混合使用
Kang 等[40] 在研究智能手机软件能否缓解患者焦虑心情时,采用了集中式和分散式两种研究方式:签署纸质知情同意时通过智能手机进行数据收集;当出现新的信息时,通过电子邮件的方式及时通知研究参与者。这种混合研究方式能够提高临床研究效率,简化研究流程,可以及时向研究参与者发布信息,并收取及时的反馈。
5.2 动态知情
在深入探索临床研究数字化转型中知情同意的伦理边界时,研究者深刻认识到知情同意并非一纸契约的终结,而是一个伴随着研究进程不断深化的动态过程。研究参与者拥有知情的选择退出权利,并且研究人员也有义务进行告知。这一过程中,自研究参与者首次签署知情同意书起,当研究方案、风险信息或预期成果发生变动时,研究人员有责任和义务第一时间告知研究参与者,并重新征询他们的意见与同意。若未能及时获得研究参与者的再次确认,他们拥有无可置疑的权利撤回先前的知情同意,并自由选择是否继续参与研究。尤其是对于儿童患者等本身就处在动态变化的弱势群体,在远程签署知情同意时,应在eIC平台加入可识别生物系统以确保屏幕前的研究参与者是其本人,而不是由其监护人代签。eIC的引入,可以提高临床研究效率,使研究团队能够更加迅速、准确地处理发生的变化,确保研究的合法性与伦理性,有助于构建以患者为中心、尊重其自主权与知情权的临床研究环境,推动医疗领域健康发展。
5.3 真实世界中广泛性知情同意的应用
在RWS 中通常通过回顾性研究获取数据,泛知情同意作为知情同意框架内的一种特殊形式,为研究人员提供了更为灵活的选项。泛知情同意专门适用于可识别生物样本的存储、长期维护以及未来可能的二次研究使用,并非是对知情同意原则的放弃,而是特定情境下的一种有效替代方案。泛知情同意之所以被视为一种有价值的选项,是因为它赋予了研究人员在初次收集数据时即能获取对未来研究至关重要的数据或生物样本的权限,且不需要在未来每次进行研究时都重新征得参与者的同意,这极大提升了研究的连续性和效率。对于此类数据的二次利用,尽管泛知情同意已初步建立了使用基础,但在具体使用患者的生物样本和生物健康大数据时,仍需要根据具体情况,可能需要再次征求患者的明确知情同意,以确保其权益得到充分尊重和保护。如果泛知情同意可以使用eIC进行替代,将会大大缩短研究进程。综上所述,泛知情同意电子化的引入不仅能够推动临床研究数字化进程,还能为RWS 的发展提供强有力的支持,通过优化数据管理和使用流程,促进医学研究的深入开展与创新。
5.4 隐私保护和信息安全
eIC作为临床研究数字化转型的关键驱动力,集成了先进的数字工具与数据基础设施,虽极大提升了研究效率与透明度,却也引入了网络安全的新挑战。相较之下,传统纸质知情同意虽面临文件遗失的风险,但其手动签署以及保存的特性在一定程度上降低了数据电子化带来的直接隐私泄露隐忧。当缺乏关于eIC的严格的数据存储、访问控制及隐私保护政策时,个人信息暴露风险将上升,并且严重威胁研究参与者的隐私权。当前,医院信息系统与临床研究eIC系统的无缝对接仍面临法律框架的空白,缺乏明确可遵循的法规指导。尤为紧迫的是,我国伦理政策体系中对于eIC所涉及隐私保护的专项伦理规范尚显不足。鉴于此,为切实保障研究参与者的隐私权益,研究实践应优先采用去标识化或匿名化处理数据,从根本上减少敏感信息泄露的风险。在知情同意签署过程中,必须确保每一步操作均符合最高标准的伦理与隐私保护要求。
总而言之,eIC的发展为临床研究数字化转型带来了更多的机遇和创新。通过搭建新的技术平台,将有希望进一步加速临床研究进展,完善伦理审查监管体系,保护研究参与者的权益。本质上,无论是使用传统纸质知情同意还是eIC的方式,知情同意所包含的要素都是不变的,eIC的产生与发展并不是要完全取代传统的纸质知情同意方式,而是随着新的研究模式的出现和数字化的转型,更加顺应时代的发展潮流,两者结合应用、优势互补,在特定场景下有不同方式可供选择,更有助于临床研究降本增效。当然,在此期间应当时刻关注研究参与者隐私保护问题,确保临床研究数字化转型过程中eIC的实施是安全和可持续的。在eIC推广过程中,应当给予研究参与者充分的选择,可以采取混合使用的方式,在技术应用成熟后,逐步替代传统纸质知情同意的方式。相信随着临床研究的数字化转型,政府、企业、科研机构及医疗机构等多方的创新生态系统将加速建设,进一步促进医疗资源的高效配置与共享,实现信息透明化,打通研究人员与研究参与者之间“看不见的墙壁”,推动临床研究向更高水平发展。
引用本文
方文婧,姚晨*,王斌,阎小妍.临床研究数字化转型过程中电子知情同意应用的机遇与挑战[J].中国食品药品监管,2024(10):24-33.

来源:中国食品药品监管杂志