您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-01-20 08:59
过继细胞治疗(adoptive cell therapies, ACTs)已经在肿瘤治疗领域取得了很多突破。ACTs通常是从患者(自体)或健康人(异体)分离免疫细胞,通过基因工程实现肿瘤抗原特异性,然后进行体外扩增,最后回输到患者体内,实现疾病治疗的目的。ACTs的种类很多,包括TILs、TCR-T、CAR-T、CAR-NK等。其中,自体CAR-T治疗是目前进展最快,上市药物最多的类型,已经有4款针对CD19、2款针对BCMA的CAR-T治疗批准上市。不过,CAR-T也有其局限性,包括疾病复发、在靶毒性、实体瘤药效不佳、成本过高等。目前已经有多种策略在解决这些问题,包括增加共刺激分子如CD28、4-1BB以改善CAR-T细胞增殖能力、存活时间,或者设计成双靶点或多靶点靶向不同肿瘤抗原以改善选择性和特异性,或者增加自杀基因设计以降低毒性,或者增加IL-12表达以克服免疫抑制肿瘤微环境等。不过,这些策略目前均还在研究阶段,需要更多数据支持。
CAR-T产品的剂量-暴露量和暴露量-效应关系是比较复杂的,受多种因素影响,包括独特的PK特征、患者相关的内因和外因影响,还有来自产品方面的一些变量,毕竟CAR-T进入人体后会增殖、分布等。另外,缺少理想的动物模型也是限制临床前向临床转化的一大障碍,影响FIH试验设计和剂量选择。来自Genentech、BMS、AZ、Janssen、Gilead、Moderna、AbbVie、Amgen的一众科学家从工业界视角分享了CAR-T临床药理学研究最佳实践,稍作分享。
细胞动力学表征
由于CAR-T属于“living drug”,进入体内后会进一步扩增,PK特点有别于传统的小分子或生物药。传统PK一般分为吸收(absorption)、分布(distribution)、代谢(metabolism)和排泄(excretion)4个过程。CAR-T经静脉给药后,PK动力学则分为distribution、expansion、contraction、persistence 4个阶段,如下图所示,即先快速分布,遇到抗原后会进一步扩增,达到Cmax后,会缓慢消除,部分CAR-T会长期存续。
CAR-T由于“CAR”的特异性,定量方法基本围绕CAR展开,常用的是PCR或者FACS方法。可以采用非房室模型计算PK参数。一般认为一个月的采样周期足以覆盖CAR-T的扩增相,衡量细胞扩增的参数主要是Cmax和AUC。Tlast和t1/2则用于衡量细胞存续时间。其它参数如清除率和表观分布容积不适用于CAR-T产品。FDA建议监测载体序列(vector sequences)的存续,直至检测不到。只要在≥1%细胞中检测到载体序列,就需要继续跟踪。如果连续两次采样均低于BLOQ,则可以停止监测。
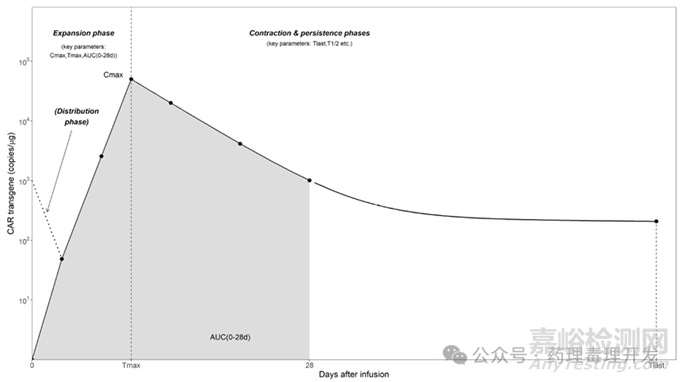
剂量-暴露量-效应关系
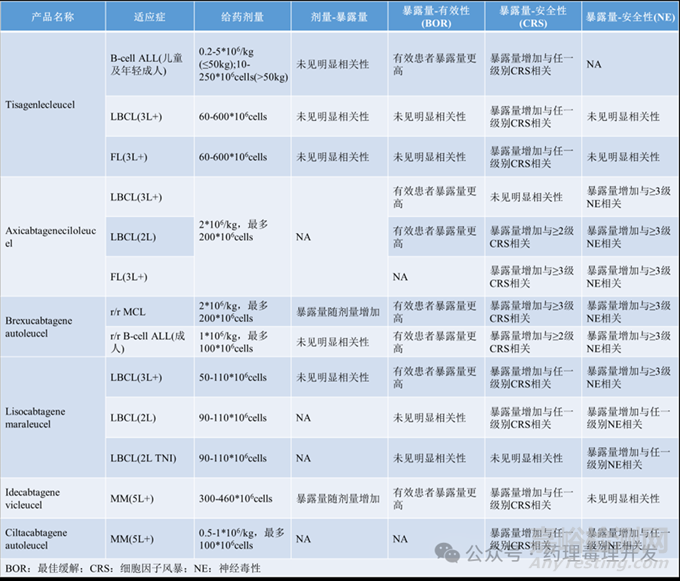
剂量-暴露量关系:已上市的CAR-T产品并未发现普遍的剂量-暴露量相关性。虽然Ide-cel在目标剂量150-450*106 CAR+T细胞观察到暴露量随剂量增加而增加,但是患者个体间暴露量变异很大,各剂量间的暴露量有一定程度的重叠。
暴露量-有效性关系:有效性是以最佳缓解作为指标。某些产品,出现响应的患者较未响应患者的CAR-T扩增更多(如Cmax和AUC0-28d),如Tis-cel(B-cell ALL)、Axi-cel-LBCL(3L+和LBCL2L)、Bre-cel、Lis-cel(LBCL(3L+))、Ide-cel(MM(5L+)),其它大部分产品或适应症则无差异。比较有意思的是,Axi-cel这个产品早期扩增这一指标,而不是3个月或更长时间的细胞浓度,与长期持续有效更相关。除了最佳缓解,其它有效性终点也做过测算。Liso-cel治疗2线LBCL,暴露量越高,PFS越长。Ide-cel在复发/难治性多发性骨髓瘤也呈现类似特征。Tisa-cel在3线及以上FL适应症中,暴露量与DOR正相关。影响CAR-T产品暴露量-有效性关系,既包括产品,还包括适应症。出现这种差异的原因可能与ORR过高,导致无响应患者比例低,样本量小,变异度大有关。此外,也可能与系统暴露量不能充分反应作用部位如淋巴结中的真实暴露情况有关。
暴露量-安全性关系:CAR-T产品的两大典型毒性分别是细胞因子风暴(CRS)和神经毒性(NEs)。已上市CAR-T产品数据显示,暴露量升高与CRS和/或NE的高发生率、AE等级存在普遍相关性。
已上市6款CAR-T产品的适应症、剂量、剂量-暴露量、暴露量-有效性、暴露量-安全性关系汇总如下表所示。
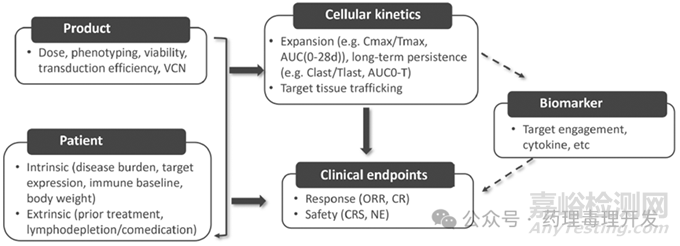
影响剂量-暴露量-效应关系的其它因素
CAR-T临床药理一般将影响因素分为患者和产品两大类,患者又分为内源性和外源性两种因素。内源性因素一般包括疾病负荷、靶点表达、免疫状态等,外源性因素则包括前序治疗、淋巴细胞耗竭、联合用药。产品相关的变量则包括T细胞类型、剂量等,如下图所示。
已经开展的tisa-cel(ALL)、liso-cel(3L+LBCL)、cilta-cel群体PK结果显示,患者人口学特征(比如体重、年龄、性别和种族等)对CAR-T产品的PK动力学没有影响。
肿瘤负荷对CAR-T的有效性、安全性或PK动力学是有影响的。比如liso-cel在3线及以上LBCL适应症中,患者肿瘤负荷越大,客观缓解率越低,CRS和NE发生率越高,细胞扩增也更多。这其中的逻辑可能是肿瘤负荷大导致细胞扩增多,从而引发安全性事件如CRS和NE的增加,但并未转化成更优的药效。Tisa-cel在弥漫大B细胞淋巴瘤中的数据同样显示,肿瘤负荷影响患者安全性,但对细胞扩增无影响。所以,肿瘤负荷对CAR-T产品的安全性、有效性、PK的影响是复杂的。
CAR-T的联合用药主要以糖皮质激素、托珠单抗为主,主要用于减轻CRS和NE。已上市CAR-T未见糖皮质激素、托珠单抗对PK、有效性的影响。当然,安全性通常会有所改善。
CAR-T毕竟是一组T细胞混合物,其中T细胞亚型对PK和有效性是有一定影响的。记忆性干细胞亚型通常与更高的缓解率相关。对axi-cel研究发现,体外更短翻倍时间,更高的CCR7+CD45RA-细胞比例,往往对应更高的体内扩增能力和更持久的药效。另外,CAR-T毕竟取自患者本身。那么患者年龄、前序治疗方案也会对CAR-T的体外扩增、后续响应产生影响。比如如果患者T细胞中含有Naïve和干细胞记忆亚型,则体外扩增量更高。如果患者接受过化疗治疗,某些早期细胞亚型降低,则可能导致体外扩增效果不佳。
首次临床剂量选择
进入人体之前,CAR-T类产品需要开展一系列体内和体外非临床研究。体外研究首先要对CAR的构造表征清楚,如结合表位、亲和力、共刺激区域等。然后,需要研究CAR-T产品的功能,包括增殖、杀伤、细胞因子产生等。另外,研究功能时,需要评估CAR-T细胞对肿瘤的敏感性,可通过设置不同的效靶比(effector to target, E:T)实现这一目的。体内药效方面,可以采用免疫缺陷鼠接种表达目标抗原的人源肿瘤细胞系,但这类模型缺少与复杂人体免疫系统的相互作用,临床转化价值有限。也有用鼠同源模型建模的,这就需要开发鼠源替代CAR-T,如下表中的YESCARTA、TECARTUS。当然,还有其它模型如免疫系统人源化模型,较免疫缺陷模型有一定优势,但都有各自的局限性。CAR-T产品可以考虑在体内药效模型中伴随PK检测。
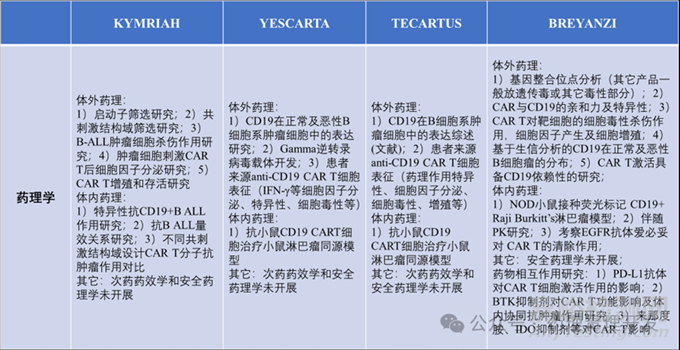
毒理方面,首先没有动物模型可以测定CAR-T临床常见的CRS和神经毒性。其次,“万能”的非人灵长类在CAR-T这类产品中是不适用的,故CAR-T是缺少毒理研究健康动物种属的。最后,由于CAR-T的高活性,采用体外手段评估脱靶反而对临床更有价值。
综上,不难发现,CAR-T产品的非临床研究数据对于临床起始剂量计算其实是有些爱莫能助的。那么,CAR-T产品的首次临床起始剂量该如何计算呢?
迄今为止,自从十多年前首个CAR-T产品进入临床,陆陆续续已有数百个CAR-T产品临床试验在推进,但对于CAR-T产品的起始剂量选择,一直没有标准路径可循。主要原因有两点,一是前文提及的非临床数据的临床转化效果一般,二是CAR-T产品属于活的药物,进入体内后会扩增。这就导致传统的基于PK或毒理终点的临床起始剂量计算路径都不太适用。FDA推荐的方法有两个,一是借助其它CAR-T产品的临床研究,二是基于产品的临床前研究数据。
首先需要进行大量的临床文献检索,对前期可参考的同类CAR-T产品的临床研究信息进行汇总。最好参考相同、相似适应症和靶点表达类似的CAR-T。比如血液瘤和实体瘤可能剂量会出现比较大的差异,毕竟CAR-T分布到实体瘤里面的量会少于血液瘤,效靶比降低,加之实体瘤微环境的影响,可能会使实体瘤需要更高的剂量。不过,目前还没有实体瘤CAR-T产品上市。现有数据显示,大部分CAR-T产品的临床起始剂量是相似的,比较多见的是1百万CAR-T/kg。
基于临床前数据进行CAR-T起始剂量计算虽然不多见,也不是完全没有。比如基于体表面积进行动物和人体剂量换算,但这种路径忽略了动物和人体内CAR-T扩增差异带来的风险。另外一种方法是,找一个靶点类似、临床安全性和有效性数据可获得的对照CAR-T产品。比较新开发的CAR-T与对照CAR-T之间的体内药效数据,获得一个活性因子。然后用这个活性因子,结合对照CAR-T的临床有效性、安全性数据,设定新开发CAR-T的剂量。这种方法对临床前体内药效模型的要求特别高。还有通过体外CAR-T扩增和肿瘤杀伤的关系,建立PK/PD模型,预测临床剂量。不过,这种计算方法还需要更多验证。

来源:药理毒理开发


