您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-11-18 08:43
质量管理体系是医疗器械安全可靠性的重要保障,而文件又是体系的重要载体。
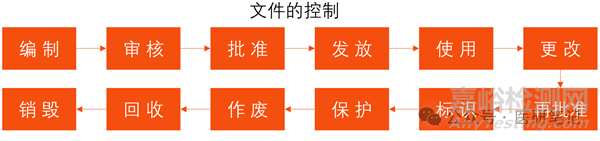
所以,从文件的诞生到销毁,都必须给予严格的控制。
具体包括:文件的编制、审核、批准、发放、使用、更改、再批准、标识、保护、作废、回收、销毁等。
No.1 文件的格式
质量管理体系文件的结构通常包含以下内容:
文件标题;文件编号;文件版本号;版本历史;文件的编制人、审核人、批准人;发布日期;生效日期;发放范围等。
No.2 文件的批准
文件发放前,应经过编制、审核、批准等控制,以确保文件的充分性与适宜性。
文件的编制应基于三个原则:
1). 能正确指导过程控制;
2). 能正确指导产品实现;
3). 符合法律法规的要求。
文件不能图“高大上”,符合自己的才是最实用的、才是最好的。
No.3 文件的使用
文件的最终目的不是摆在书架上生灰的,而是为生产制造服务的。
尽量不要让其成为“花瓶”。
在工作现场,员工应该可以获得并查阅到相关文件,如作业指导书、操作规程、质量检验要求等等。
让“文件”成为技术迭代的助推器,尽量减少“师傅带徒弟”的情况,尤其在这乌卡时代。
No.4 文件的升版
管理是动态的,文件的升级换版是质量提升的体现。
日常经营过程中,发生以下情况时,或被动、或主动地对文件进行评审,然后修订改版。
1). 组织机构、人员、或设施设备等发生变化
新增部门、合并部门;新招员工、员工离职,尤其是管理层;设施或设备发生变更等等,均需要对相关文件进行评审、修改、升版,诸如质量手册、人力资源控制程序、作业指导书等。
2). 审核后的不符合项
药监局检查后、客户检查后,内部审核后、管理评审后,或多或少会开出几个不合格项。
这时,企业通常需要采取修订文件,作为整改措施。
3) . 获得新的信息
企业从外部获得新的信息时,比如从监管局、从客户等获得正面信息,对质量控制、降低成本、过程改善等等有益的,通常会将这些信息转换为企业内部的体系文件,形成一种无形的资产。
4). 产品的更新
当公司新增或注销产品时、或者某一个产品发生技术变更时,也会引起相关技术文件的变化。
5).文件修改后的批准
文件修改后,最好还是由原部门批准。
如果指定其他部门批准,指定的部门应该了解相关背景后,方可签字批准。
No.5 状态的识别
应该识别所有文件的修订状态,如编写受控文件清单(及时更新)、文件修改一栏表等形式识别最新状态。
管理者代表或者质量体系负责人,应能准确识别某一份文件是否是现行版本。
No.6 文件应清晰、易于识别
质量体系是个庞大的体系,相关文件少则为几十份,多则上千份。
所以,编制时,最好统一规划,比如:
给某一层级的文件,规定特定代号;
给某一类的文件,规定特定代号;
给某一个部门,规定特定代号;
再加上文件编号,让文件结构清晰、明了,易于识别文件的种类和性质。
No.7 防止文件损坏或丢失
在生产现场的文件,或者经常翻阅的文件往往特别容易损坏或丢失。
此时,使用部门应该采取有效措施防止损坏或丢失,如对文件进行塑封、将文件贴于墙上等。
No.8 作废文件的管理
1). 防止非预期使用
应将作废的文件,及时收回,并盖作废章。
现场切勿出现作废过期的版本。
实在因工作需要,查阅之前版本的文件,应该严格做好标识。
2). 至少保存一份作废文件
文件作废了,但是在该文件指导下生产的产品并没有作废。
为了追溯、或者指导当时产品的正常使用,这个作废的文件就相当重要了。
所以,至少保存一份作废文件,其期限不少于产品的有效期、客户要求和适当法规的要求。
No.9 文件的销毁
按规定保存到期后,按照“文件销毁”控制程序进行销毁。
至此,“文件”已完成了它的使命。

来源:医研笔记


