您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-24 17:35
导读
在生物制药领域,重组蛋白的生产是一项至关重要的技术,而大肠杆菌表达系统因其诸多优势,如生长迅速、易于培养、遗传背景清晰等,成为了生产重组蛋白的常用选择。然而,要在大肠杆菌中实现高效、高质量的重组蛋白表达,并非一帆风顺,而是面临着诸多挑战。今天,让我们一起解读发表于International Journal of Biological Macromolecules(IF:7.7)的文章“Strategies for optimization of heterologous protein expression in E. coli: Roadblocks and reinforcements”,探讨实现天然重组蛋白产量最大化的策略。
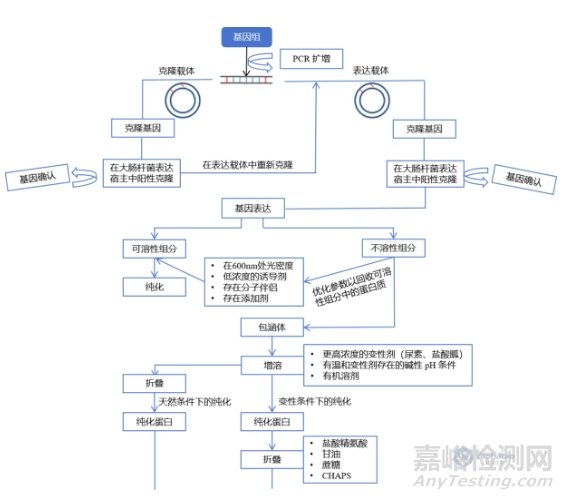
图1 在大肠杆菌中目的基因异源表达的示意图
一、大肠杆菌重组蛋白表达的基础要素
重组蛋白的表达依赖于表达载体和宿主的协同作用。表达载体是实现基因转录和翻译的关键工具,其包含多个重要元件(图2)。其中,启动子尤为关键,它如同基因表达的“开关”,控制着转录的起始。理想的启动子应具备强大的转录活性,以确保目的蛋白的高效积累,同时还需具备严格的调控能力,防止产物毒性对宿主细胞造成损害。在大肠杆菌表达系统中启动子的种类繁多(如lac、tac、trc),每种启动子都有其独特的性能,可以根据蛋白的性质和需求进行选择。同时,为了提高蛋白表达水平,一些研究对启动子进行了优化,如通过对lacUV5启动子进行突变,或调节T7 RNA聚合酶的活性,来优化膜蛋白基因的转录[1]。在实际应用中,可根据蛋白的具体情况,选择合适的启动子优化策略,以达到最佳表达效果。

图2 大肠杆菌表达载体的关键部分
宿主菌株的选择对于重组蛋白的成功表达至关重要,需根据表达载体的特性进行适配。此外,针对一些特殊蛋白,如膜蛋白、含有稀有密码子的蛋白或对细胞有毒性的蛋白,还需选用经过特殊改造的宿主菌株,这些菌株通过优化自身的基因表达调控机制或蛋白质折叠环境,能够更好地适应这些难表达蛋白的生产需求。例如,Rosetta菌株携带了识别稀有密码子的tRNA基因,可有效解决因密码子偏好导致的表达问题;Origami、Origami B、Rosetta-gami和SHuffle等菌株则通过突变关键基因,增强了胞内二硫键的形成能力,有利于含有二硫键的蛋白正确折叠[2]。
二、影响重组蛋白表达的关键因素
2.1蛋白特性的影响
蛋白的大小对其在大肠杆菌中的表达有着显著影响,小于100kDa的蛋白通常较易表达,而大于100kDa的蛋白则可能面临表达困难,甚至被降解或提前终止翻译的问题,且小蛋白(<10kDa)也可能因折叠不当和易受蛋白酶降解而难以稳定表达。不同生物对密码子的使用存在偏好可能导致重组蛋白在大肠杆菌中表达时出现问题,当mRNA中的密码子不被宿主细胞的tRNA识别时,会出现翻译停滞、提前终止、移码或氨基酸错误掺入等情况,从而降低蛋白表达的数量和质量。
2.2 蛋白毒性的挑战
部分重组蛋白对宿主细胞具有毒性,这会严重阻碍其表达。这些毒性蛋白可能干扰宿主细胞的正常生理功能,如破坏细胞膜完整性、影响代谢途径或引发细胞应激反应,导致细胞生长受限甚至死亡。因此,在表达这类蛋白时,必须采取特殊策略,如使用严格调控的表达载体。
2.3膜蛋白表达的难点
由于膜蛋白通常具有跨膜结构域,其在细胞内的过量表达容易使Sec转运系统饱和,导致蛋白无法正确插入细胞膜,进而在细胞质中聚集形成包涵体。此外,膜蛋白的疏水性使其易于相互作用并聚集,进一步加剧了表达和折叠的困难。为克服这些问题,研究人员尝试通过调控转录水平来控制膜蛋白基因的表达速度,减少蛋白聚集的发生。
2.4蛋白翻译后修饰的需求
许多真核来源的蛋白质需要特定的翻译后修饰才能具备生物学活性,如二硫键形成、糖基化等。然而,大肠杆菌作为原核生物,其细胞质环境呈还原性,不利于二硫键的形成,这会导致含有二硫键的蛋白无法正确折叠,从而失去活性。对于一些需要复杂糖基化修饰的蛋白,大肠杆菌表达系统则无法满足其修饰需求,此时则需选择真核表达系统来实现蛋白的正确修饰和功能表达。
三、重组蛋白表达的优化策略
3.1诱导条件的精细调控
诱导剂的浓度对蛋白表达至关重要,浓度过低会导致诱导效率低下,蛋白表达量不足;而浓度过高则可能产生毒性,抑制细胞生长,同时使蛋白合成速度超过折叠能力,导致包涵体形成。因此,针对不同蛋白,需精确优化诱导剂浓度,以实现高效可溶性表达。此外,温度对蛋白表达影响也很显著,较低温度通常有助于减少蛋白聚集,提高可溶性蛋白的比例,因为低温可降低疏水相互作用,抑制蛋白聚集反应。然而,对于某些蛋白,高温或热休克处理在诱导前进行,可通过激活热休克蛋白等机制,提高蛋白的溶解度,避免其进入包涵体。诱导时的细菌生长阶段也会影响蛋白表达,在早对数生长期诱导,通常可获得较高的蛋白产量和活性,同时降低内源性蛋白的干扰,有利于蛋白纯化。但在某些情况下,晚对数期或稳定期诱导可能对特定蛋白的表达更为有利,如对于对宿主细胞有毒性的蛋白。
3.2培养基成分的优化
由于大肠杆菌的二阶段生长特性,葡萄糖的存在会抑制乳糖操纵子的表达,即所谓的“代谢物阻遏”现象。在诱导前添加适量葡萄糖可有效抑制基础表达,减少毒性蛋白对细胞的损害。同时,合理控制葡萄糖浓度还能调节细胞生长和重组蛋白表达,避免葡萄糖过量导致的细胞生长抑制和蛋白表达下降。此外,如表1所示,向培养基中添加特定添加剂可改善蛋白折叠和稳定性,从而提高可溶性蛋白的产量[3]。
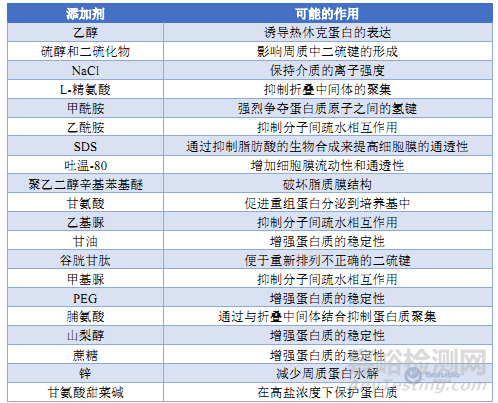
表1 添加剂及其可能的作用
3.3融合标签的应用策略
融合标签是提高蛋白可溶性表达和简化纯化过程的有效手段。例如,麦芽糖结合蛋白、谷胱甘肽S-转移酶、硫氧还蛋白等标签(表2),它们不仅能促进蛋白正确折叠,还可通过亲和层析实现一步纯化。为将重组蛋白转运至周质空间或分泌到培养基中,可使用特定信号序列或融合标签,如PelB、OmpA、PhoA等信号序列可引导蛋白通过内膜转运至周质空间,利用周质空间的氧化环境促进二硫键形成,提高蛋白稳定性和活性[4]。
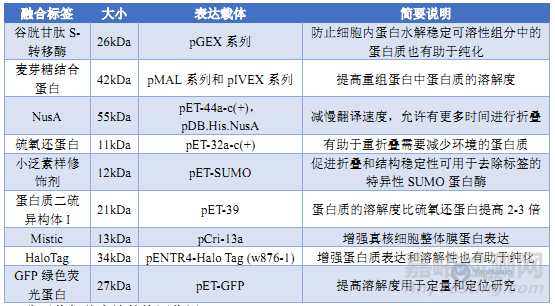
表2 用于可溶性蛋白表达的各种融合标签
3.4分子伴侣共表达的协同作用
分子伴侣在蛋白折叠过程中发挥着关键作用,它们能够协助新生多肽链正确折叠,防止其聚集形成非功能性结构。在大肠杆菌中,共表达分子伴侣如GroEL/GroES或DnaK/DnaJ/GrpE系统,可显著提高某些难表达蛋白的可溶性和活性[5]。然而,不同蛋白可能需要特定的分子伴侣协助,因此准确识别并共表达与之匹配的分子伴侣至关重要。通过优化分子伴侣的共表达策略,可有效改善蛋白折叠环境,提高蛋白表达质量。
结语
大肠杆菌表达系统在重组蛋白表达中具有重要地位,但面临诸多挑战。通过深入理解影响蛋白表达的各种因素,并针对性地运用优化策略,如精细调控诱导条件、优化培养基成分、合理应用融合标签、共表达分子伴侣以及有效处理包涵体等,能够显著提高重组蛋白的表达水平和质量。随着生物技术的不断发展,相信未来会有更多创新策略涌现,进一步推动大肠杆菌表达系统在生物制药、工业酶生产等领域的广泛应用,为生命科学研究和人类健康事业做出更大贡献。
参考文献
[1] Wagner S, Klepsch MM, Schlegel S, Appel A, Draheim R, Tarry M, Högbom M, van Wijk KJ, Slotboom DJ, Persson JO, de Gier JW. Tuning Escherichia coli for membrane protein overexpression. Proc Natl Acad Sci U S A. 2008, 105(38):14371-14376.
[2] Lobstein J, Emrich CA, Jeans C, Faulkner M, Riggs P, Berkmen M. SHuffle, a novel Escherichia coli protein expression strain capable of correctly folding disulfide bonded proteins in its cytoplasm. Microb Cell Fact. 2012, 11(1):753.
[3] Patil G, Rudolph R, Lange C. In vitro-refolding of a single-chain Fv fragment in the presence of heteroaromatic thiols. J Biotechnol. 2008, 134(3):218-221.
[4] Malik A. Protein fusion tags for efficient expression and purification of recombinant proteins in the periplasmic space of E. coli. 3 Biotech. 2016, 6(1):44.
[5] Voulgaridou GP, Mantso T, Chlichlia K, Panayiotidis MI, Pappa A. Efficient E. coli expression strategies for production of soluble human crystallin ALDH3A1. PLoS One. 2013, 8(2):e56582.

来源:Internet


