您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2025-01-10 08:24
基因过表达即将目的基因的编码序列克隆到相应的质粒或病毒载体上,从而使基因在人为控制的情况下实现大量转录和翻译,实现基因的过表达。在整个实验过程中载体构建是整个实验的开始。
实验步骤:
1.PCR目的基因片段(如已有目的基因片段可忽略):
选择细胞提RNA,逆转录成cDNA,根据PCR酶配置相应体系进行PCR,得到相应的目的基因片段,同时跑琼脂糖凝胶进行酶切鉴定,根据目的基因的片段大小判断条带应该出现的位置,根据位置判断酶切目的基因片段是否成功。
2.双酶切目的基因:
酶切位点选择和过表达载体相同的酶切位点,常见酶切体系如下:
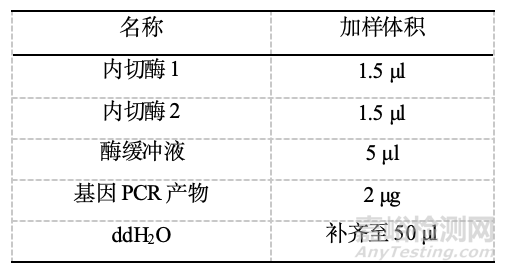
37℃酶切1h。
3.双酶切过表达载体(以常见的过表达载体plvx-IRES-neo为例):
选择和目的基因片段相同的酶切位点,以相同条件进行酶切,酶切完成后需跑琼脂糖凝胶鉴定载体酶切是否成功,同时进行胶回收并测定相应浓度。
4.酶切后载体与目的基因连接:
常见连接体系如下:

16℃连接4 h或过夜,连接完成后产物可暂存于冰箱4℃。
5.连接产物转化、摇菌、测序:
连接产物转化摇菌及提质粒均按常规步骤操作即可,质粒提取结束根据浓度取一定微升的原液送公司测序,查看载体构建是否成功。
注意事项:
1.上述步骤中涉及多次琼脂糖凝胶鉴定,配置琼脂糖凝胶时遵循目的基因片段越长,胶浓度约低的原则,目的基因及载体片段大小应提前进行查询。
2.PCR目的基因片段时,应提前设计好相应引物,我所使用的酶为KOD酶,根据说明书配置体系即可。
3.目的基因及载体的双酶切位点可从文献中查询或听取导师意见,酶缓冲液的选择可在NEB官网中进行查询,同时酶切时间及条件由内切酶自身决定。
4.连接过程中我所举例的酶为T4连接酶,连接酶的选择根据自身条件决定,但需注意选择用哪个公司的连接酶,其缓冲液应配套使用,防止降低连接效率,同时加样量并不固定,实验开始前需仔细进行计算。
5.在配置酶切及连接体系时酶应在最后加,实验开始前应混匀。

来源:实验老司机


