您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-25 18:18
导读
近年来标签辅助蛋白纯化是学术研究和大规模工业需求的首选方法,在蛋白质生产过程中应用纯化标签有助于节省时间和成本,但标记融合蛋白的设计和应用具有挑战性,适当的标记策略必须保证最终蛋白产品的表达量和高纯度,同时保持其天然结构和功能。伊朗研究人员曾在Biotechnology Advances上发表了题目为《Opportunities and challenges of the tag-assisted protein purification techniques: Applications in the pharmaceutical industry》的综述。详细介绍了蛋白质和肽结构的纯化标签的分类、选择及在亲和、离子交换、反相和固定化金属离子亲和色谱中的应用。
一、蛋白纯化标签概述
蛋白纯化标签是一种在蛋白表达体系中引入特定序列或结构的标签,利用这一标签与其它分离手段的相互作用,实现对目标蛋白的高效纯化的技术。标签可以是一个完整的酶,一个蛋白质结构域或一个小的多肽链。它们可以结合一系列底物,如碳水化合物、小生物分子、金属螯合剂和高特异性抗体,并有助于提高相关对应物的回收率和产量[1]。
二、蛋白质和肽标签的一般分类
标签可以添加到目标蛋白的任何一端,因此它们可以是c端特异性的或n端特异性的或c端和n端特异性的。从生物化学角度看,标签可分为非干扰性标签和干扰性标签。
2.1非干扰性标签
非干扰性标签如组氨酸标签His-tag和钙调蛋白结合肽(Calmodulin-Binding Peptide,CBP)等,纯化后不需要去除标签序列,并且一些非干扰性标签对重组蛋白的性质和功效有多种积极影响。可以提高生产产量和质量、促进蛋白质正确折叠、防止蛋白水解、抑制融合蛋白的抗原性、改善功能特性及增加目标蛋白的溶解度等。一些基于标签的系统(如荧光标签)还可用于跟踪蛋白质表达和纯化过程。
2.2干扰性标签
干扰性标签如麦芽糖结合蛋白(Maltose-Binding Protein,MBP)和谷胱甘肽S转移酶(Glutathione S-Transferase,GST)等,通常较大,会干扰主蛋白的结构和功能,所以纯化后必须去除。其缺点包括生物活性改变、蛋白质产量降低、产生毒性、结构灵活性不当、蛋白质聚集或错误折叠等。有时可通过特定的蛋白酶系统去除标签,并且在设计干扰性标签时,需要在目标蛋白和标签序列之间设置特定的蛋白酶位点。
三、蛋白纯化最佳标签的选择
为标签辅助纯化系统引入最佳标签时应考虑多种因素,包括易于去除、单步纯化、对蛋白质结构和功能的影响最小、多功能性和可及性等[2][3]。当标签在目标蛋白内折叠时,这一过程可能会受阻,因此在为每个实验选择合适的标签时,同时还需考虑其他因素如蛋白质类型、表达系统的性质以及目标蛋白的后续应用[4]。例如His-tag纯化系统对二氢叶酸还原酶(Dihydrofolate Reductase,DHFR)的纯化比组蛋白乙酰转移酶(Histone Acetyltransferase,HAT)更有效。
四、标签辅助色谱法纯化蛋白
4.1标签辅助亲和色谱法
亲和色谱是生物技术竞争市场中最常用的工具。一组两种生物分子(如抗原-抗体、激素-受体和酶底物)之间的选择性和特异性相互作用是亲和系统设计的基础。在每一个亲和体系中,这对分子中的任何一个都固定在固体载体(主要由琼脂糖或二氧化硅基质组成)上,形成亲和配体,在通过色谱柱时帮助捕获对应的配体。最后在彻底清洗不可保留的成分后,使用合适的洗脱缓冲液从色谱柱中回收有价值的亲和配体。根据参与亲和相互作用的配体的性质,亲和系统可分为四大类:免疫亲和(基于抗原抗体或表位抗体相互作用);特定配体生物亲和性(基于酶与其相应的特定底物、抑制剂或辅助因子的相互作用,以及特定的激素受体相互作用);一般配体生物亲和性(基于某些生物分子对一组配体的一般亲和性)及适配体亲和层析(Aptamer Affinity Chromatography,AAC)。

图1 标签辅助的一般配体生物亲和性和特定配体生物亲和性纯化
4.2标签辅助固定化金属离子亲和色谱法
固定化金属离子亲和层析(Immobilized Metal Affinity Chromatography,IMAC)系统是基于一些蛋白质和肽序列对金属离子的亲和性。这些蛋白质和肽序列必须包含能与金属离子形成强配位共价键的电子供体原子(如在组氨酸、谷氨酸、天冬氨酸、半胱氨酸和丝氨酸中发现的氮、硫或氧),金属离子使用螯合连接剂固定在色谱树脂上,螯合连接剂可能针对某些类别的金属离子。螯合连接剂和金属离子都将决定色谱柱对蛋白质和肽序列的选择性。例如,Ni2+、Co2+和Cu2+柱更适合吸附富含组氨酸的序列,而Fe3+和Zn2+柱更适合吸附磷酸化蛋白。设计含有电子给体原子残基的标记序列可以促进IMAC在蛋白质纯化中的应用。组氨酸标签His-tag是最常用的标签之一,可用于多种蛋白质的分离,包括重组蛋白和抗体,具有小且非干扰性等优点。6个poly-His标签序列被认为是最常见的融合标签,在60%以上的晶体学研究中作为载体驱动标签被广泛使用。它还可以在免疫亲和层析中用作表位标签。还有基于其他蛋白质改造的具有金属结合特性的标签。
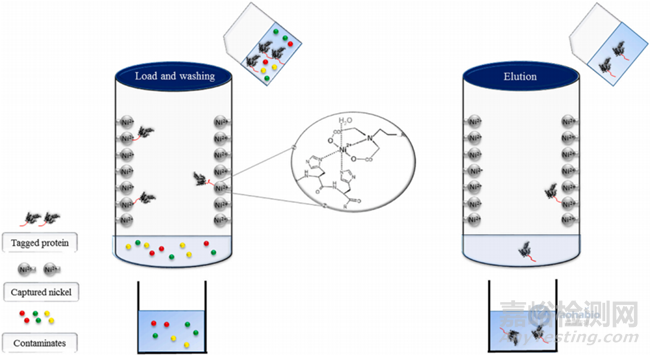
图2 固定化离子亲和层析(IMAC)
4.3标签辅助离子交换色谱法
蛋白质和多肽可能含有多种可滴定残基,在给定的pH下,它们的电离状态将决定它们的电荷,从而决定它们所参与的序列的净电荷。通过调节溶液的pH值和/或离子强度,可以很容易地调节蛋白质和肽的净电荷,这使它们成为离子交换色谱(Ion Exchange Chromatography,IEC)柱分离的绝佳选择。IECs中的固定相由固体树脂组成,固体树脂与离子交换基团共价键合。这些离子交换基团既可以是正电荷(阴离子交换剂)也可以是负电荷(阳离子交换剂)。磺酸和羧酸是阳离子交换剂的典型代表,叔铵和季铵阳离子是阴离子交换剂的经典代表。根据肽和蛋白质序列的净电荷,在给定的pH值下,它们可以被静电吸附到离子或阳离子交换器上,并通过IEC柱分离。与其他色谱方法相比,IEC更便宜,耐受性更强,但特异性较差。因此目前在不断努力提高IEC的选择性,特别是在生物医学应用方面。设计一个足够带电的标签,可以连接到目标蛋白而不干扰其天然结构,是基于IEC的蛋白纯化方案的决定性策略。理想的标签序列将在其靶蛋白和离子交换剂之间提供更强的吸附,这意味着更有效的标签系统需要更严格的洗涤条件。

图3 离子交换色谱示意图
4.4标签辅助反向色谱法
在反向色谱(Reversed Phase Chromatography,RPC)中分子根据其疏水性和吸附在疏水固定相上的倾向进行分离。制备RPC疏水树脂的常用策略是将不同链长的碳氢化合物固定在固定相上,得到一系列反相吸附剂(如C4、C8或C18柱)。样本在极性溶剂中加载,疏水组分吸附在疏水性树脂上(热力学有利的方式),然后用极性逐渐降低的洗脱缓冲液回收,RPC可用于分离非常相似的蛋白质和肽。与其他色谱技术相比,RPC更具经济性和非破坏性。尽管在折叠过程中,大多数疏水残基倾向于埋藏在蛋白质结构内部,但那些留在表面的残基将成为蛋白质参与的许多选择性疏水相互作用的关键参与者(例如膜运输,几种酶活性等)。常用的标签包括多聚苯丙氨酸、多聚异亮氨酸和多聚酪氨酸等,其中最常见的是色氨酸基序列。一些特殊的标签设计如C9R是一种用于提高烟草蚀纹病毒(Tobacco Etch Virus,TEV)蛋白酶溶解性和表达产量的标签。
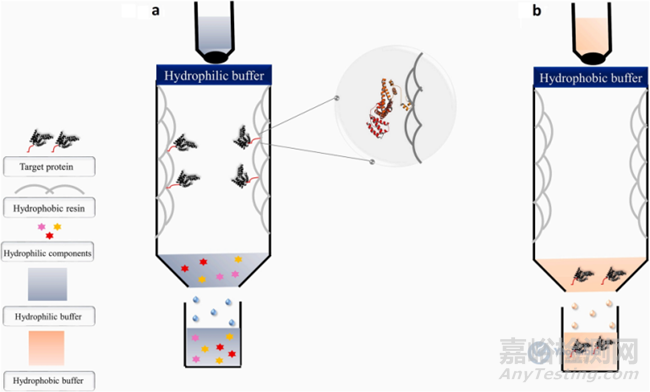
图4 反向色谱示意图
结语
由于生物信息学的最新进展和高通量技术的出现,许多新的标签被引入市场,各种干扰和非干扰标签已经超出了作为简单的净化工具的传统用途,拓宽了其应用范围。目前在简化蛋白质生产过程方面已经取得了很大进步,但是在设计和/或选择适合特定应用的标签时仍然需要考虑多种因素,并且在标签技术的成熟方面还有待取得更大进展。
参考文献
[1] Yeonju Lee, Kyung-Min Kim, et al (2023). Cyclized proteins with tags as permeable and stable cargos for delivery into cells and liposomes. International Journal of Biological Macromolecules.252.
[2] Kinrade, B., Davies, et al (2020). Bacterial sugar-binding protein as a one-step affinity purification tag on dextran-containing resins. Protein Expr. Purif. 168, 105564.
[3] Zhao, F., Song, et al (2020). Purification and immobilization of α-amylase in one step by gram-positive enhancer matrix (GEM) particles from the soluble protein and the inclusion body. Appl. Microbiol. Biotechnol. 104 (2), 643–652.
[4] Xinyi Wang, Xinxin Feng, et al (2023).Promoting soluble expression of hybrid mussel foot proteins by SUMO-TrxA tags for production of mussel glue.International Journal of Biological Macromolecules. 225, 840-847.

来源:Internet


