您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-02-14 19:43
自新版《药品注册管理办法》实施后,创新药申报数量稳步增长,2024年,新药审评审批体系优化,在部分地区开展优化创新药临床试验审评审批试点,将审评审批时限由60个工作日缩短为30个工作日;审评审批效率得到提升,对珍稀濒危药材替代品的申报品种予以优先审评审批,这一政策有利于推动珍稀濒危药材替代品的新药研发和应用,也加快了相关中药新药的注册审批速度。回望2024年中药审评审批情况,多个亮点值得关注。
上市新药概况
2024年,国家药监局(NMPA)共批准11个中药新药品种上市许可申请,包括:3个中药创新药1.1类中药复方制剂(近5年NMPA批准中药创新药上市许可品种数量走势见图1),8个中药新药3类古代经典名方中药复方制剂,其中7个为3.1类按古代经典名方目录管理的中药复方制剂、1个为3.2类其他来源于古代经典名方的中药复方制剂,芍药甘草颗粒有2个上市许可持有人(详见表1)。
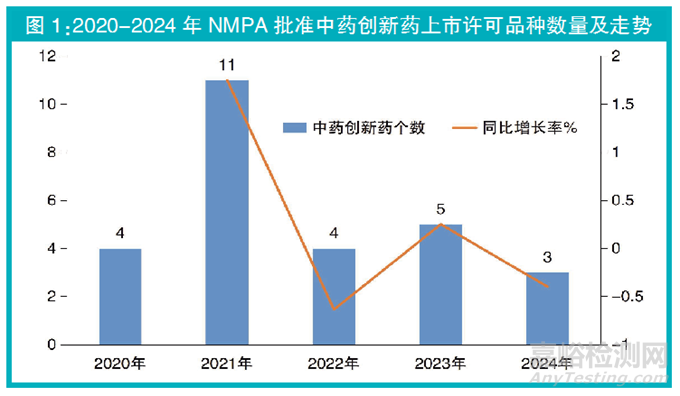
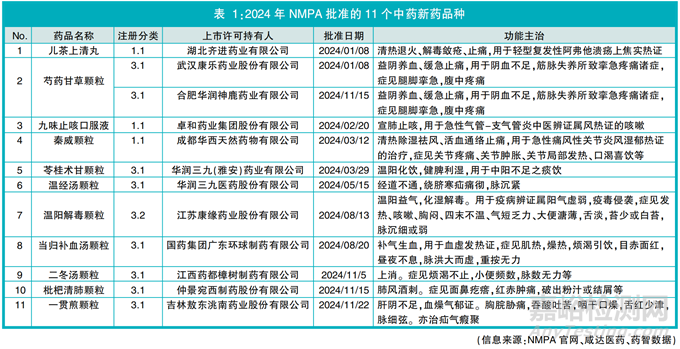
多为颗粒剂 2024年过审的中药新药剂型以颗粒剂为主要剂型。11个中药新药中颗粒剂占81.8%(9/11),口服溶液剂占9.1%(1/11),丸剂占9.1%(1/11)。
3.1类申请活跃 2024年7个中药3.1类新药获批上市许可的背后,是中药3.1类新药申请生产活跃、审评审批创历史新高。2024年中药3.1类新药申请生产有28件,同比增长115%[(28-13)/13]。(详见图2)

新药上市申请受理增长
据咸达医药,2024年,国家药监局药审中心(CDE)受理中药新药上市许可申请(NDA)41件,同比增长64%[(41-25)/25]。
2024年CDE共受理1.1类中药新药NDA11个,其中小儿黄金止咳颗粒和龙七胶囊已纳入优先审评审批程序;3.1类经典名方共计15首方,29个受理号,其中有3个中药3.1类新药品种(二冬汤颗粒、枇杷清肺颗粒、一贯煎颗粒)在当年承办受理,当年审评审批中药上市许可,平均审评审批时长约为300天(按自然天计算)。同名同方药2个。
临床试验默示许可提速
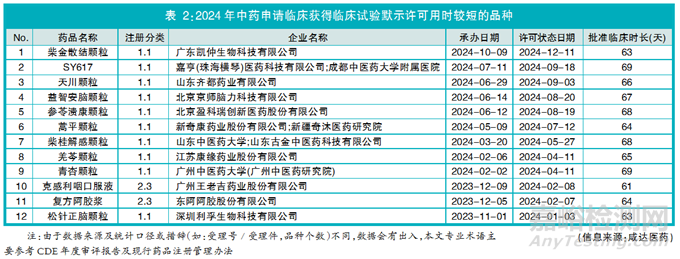
2024年获得中药临床试验默示许可批件61件,同比下降3%[(61-63)/63],临床申请承办受理日期至获得临床试验默示许可状态日期时长约为75天(按自然天计算),其中多个品种批准临床时长不超过70天(详见表2),最短的为克感利咽口服液的61天。
其中,中药1类创新药有49件(其中1.1类有45件,1.2类有4件)获得临床默示许可,占获得临床默示许可件数的80%(49/61),2023年为73%(46/63)。从国家一系列对中药利好政策支持及近三年中药1类创新药获得的临床默示许可件数(2022年27件、2023年46件、2024年49件)来看,未来3~5年,每年将有10个或以上中药1类创新药获得新药上市许可,中药的创新将进入快速发展阶段。
中药临床申请受理100件
2024年,CDE受理中药临床试验申请100件,同比增长37%[(100-73)/73]。
提取物及制剂、同一品种多个规格、同一品种多次申请均按一个品种计算,共86个品种,以下数量均按品种计算。
其中1.1类57个,1.2类7个,1.3类1个;改良型新药共计20个,其中2.2类2个、2.3类18个;同名同方药1个。
来源:《医药经济报》2025年第5期

来源:医药经济报


