您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-02-14 20:10
药品研发质量管理属于系统的综合工程,通过保障药品研制的合规性与科学性,降低研发过程的不确定性,避免注册申报风险及商业化生产的隐患,其现实意义已成业内共识。
但如何针对药品研制工作的灵活性、创新性特点,结合其不同研究阶段数据及记录管理的特殊性,构建合理的药品研制质量管理体系,也是业内关注的热点。
对于质量管理体系的基础要素及构架参照ICHQ10、ISO系列文件等即可实现,但是不同研发机构的团队能力、研发产线、项目风格不尽相同,体系的建立可谓是量体裁衣。
笔者通过对药品研制阶段相关法规的梳理与监管机构官方检查报告的分析,总结出三个执行要点,即:“合规性”、“灵活性”“、”长期性”,以此为思路搭建药品研制质量管理体系,并充分发挥风险管理和知识管理的内驱力持续改进,以期为诸位的质量管理工作抛砖引玉。
1、以法规文件为基石,把握质量管理“合规性”
质量管理体系的根本要求就是保证药品研制工作符合当前法律法规及技术指南的要求。在现有监管框架下,药物审评及现场核查工作对药品研制阶段的合规性提升到了新的定位,特别强调药品研制阶段应当保证研发全过程信息的真实、准确、完整和可追溯。所以跟进学习法规、调整管控思路,显得至关重要。
相关法规文件的梳理
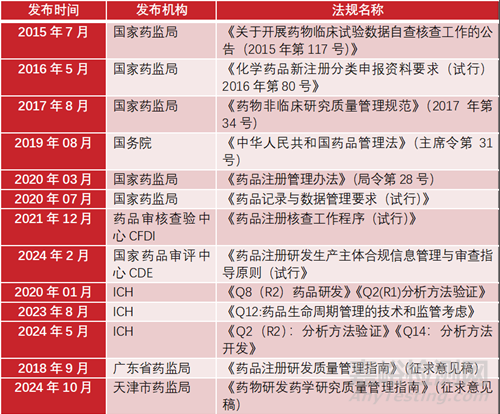
其中,《药物非临床研究质量管理规范》强调了数据管理和计算机化系统的规范管理;《药品记录与数据管理要求(试行)》是一个针对药品全生命周期管理的数据管理规范;《药品注册核查工作程序(试行)》明确要求建立研发质量管理体系;《药品注册研发生产主体合规信息管理与审查指导原则(试行》进一步深化和完善研发质量管理体系的要求。
直至天津药监局最新发布的《药物研发药学研究质量管理指南》(征求意见稿)依据前期国家药物监管部门颁发的相关文件,并参考ICH的Q8、Q9、Q10、M4等技术指南文件相关规定,形成共计十二章四十条。对药物研发环节质量体系提出了统一的管理标准,细化至操作执行层面,对于药品研制阶段的质量管理体系搭建可谓是指路明灯。
2、以核查要点为依据,保持质量管理“灵活性”
与基于产品的上市前GMP符合性检查(PAI)相比,药品注册核查主旨是为审评审批提供支持,核查全过程均强调基于风险。
《药品注册核查要点及判定原则》对药理毒理学研究、临床试验、药学研制和生产现场制定了对应的核查要点,基于风险研判,部分研制工作可仅对记录及数据等资料进行核查。故药品研制从开发到商业化生产活动推进的过程中遵循越来越高标准的要求,质量管理要素和质量管理模块上可依据风险执行分阶段分要求管控策略。
小试阶段执行“非GMP”管理,中试阶段及临床(Ⅰ~Ⅱ期)执行“GMP-like”管理,临床(Ⅲ~Ⅳ期)工艺验证及上市阶段执行GMP管理。
例如,在研发处方和工艺筛选阶段以效率优先,可暂不引入变更系统,节约管理成本。而临床样品和注册批样品的生产及检验、分析方法验证等过程所涉及的验证工作应按照GMP(药品生产质量管理规范)要求开展,对验证过程中发生的偏差和变更,应按照处理流程执行调查跟踪并归档。
但对数据可靠性的管理,无论任何阶段都必须作为核心要点,且将贯穿始终。
不同药品研制阶段质量管理工作要点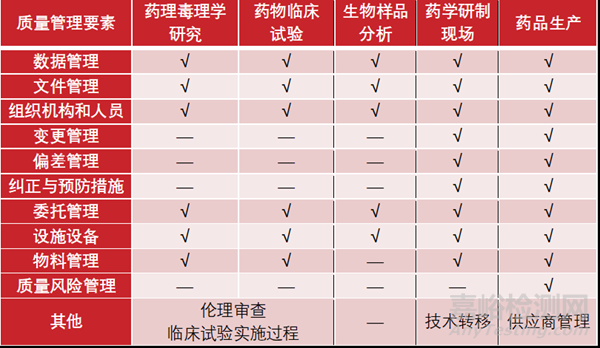
梳理国家药品审核查验中心CDE发布的《国家药监局核查中心2022年度药品检查工作报告》(2023年10月)显示,在1377个药品注册核查任务(药品注册药学研制/生产现场核查任务884个、仿制药质量和疗效一致性评价研制/生产现场核查任务82个)中发现的主要问题包括:
图片
《药品检查报告》中关于研发阶段核查发现的典型性问题,数据可靠性/完整性问题较为突出。
药品研制质阶段做好数据可靠性管理离不开系统设计、规划与落实,延申至质量管理工作环节包括与数据可靠性相关的人员培训与要求、制定并建立数据管理程序与措施(包括纸质记录和电子数据)、配备与所开展工作相适应的计算机化系统与软件并进行适宜的验证、建立并实施数据可靠性保证措施等方面。
3、以质量模块为切口,保障质量管理“长期性”
研发质量管理体系应伴随着研发中实际发生的问题不断改进,这个过程需要研发质量管理人员不断思考、磨合,然后基于实际进行调整,可引入质量管理模块协助实现持续改进的良好态势,如自检、管理评审、CAPA。
① 质量管理体系的自检应至少每年开展一次,自查已制定的SOP执行情况以及新出台政策法规的落实情况。
② 在研发过程中,完成阶段性项目后,需要及时落实评估措施,从技术、质量等多方面实施评审,确保项目稳定实施,对于需要变更的项目还需要建立质量改进模式,保证变更项目的追溯性。
③ 定期进行管理评审活动,向管理层汇报研发质量管理体系的运行情况,以及带来的收益和现存的风险,使决策者可以基于真实信息和数据做出决策。
④ 在研发实验室执行方法学验证及稳定性研究阶段,或对临床样品进行检测时,应引入偏差管理和变更管理,把握研发关键环节及重要数据的可靠性,持续提高实验室管理水平。
此外研发工作流程的规范化,项目结束以后药品研发的综合分析,及时落实资料申报、产业化支持以及档案管理等相关工作等,诸多方面,对提高药品开发质量都具有积极意义。在此不再展开论述,各研发机构可结合自身项目特点,兼顾角色、流程和技术同步考虑,引入适宜的管理模块,助推体系的持续提升。
研发质量管理体系的设计,是一个长期课题,需要根据自身人员能力、资源规模和技术实力理性搭建,而非脱离现实的盲目模仿。希望上面的内容对大家在建立药品研发质量管理体系时有所裨益。

来源:蒲公英Ouryao


