您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2025-03-05 08:44
1. 实验原理/概述
DiD(红色荧光)是一类亲脂性荧光染料家族,常用于标记细胞膜和疏水性组织。作为一类环境敏感型荧光染料,当它们与膜结合或者与亲脂性生物分子结合时,其荧光强度显著增强,为活细胞多色彩荧光成像分析和流式细胞术提供了一种便捷的工具。这里将介绍DiD(红色荧光)标记外泌体被细胞摄入的实验,具体操作步骤如下:
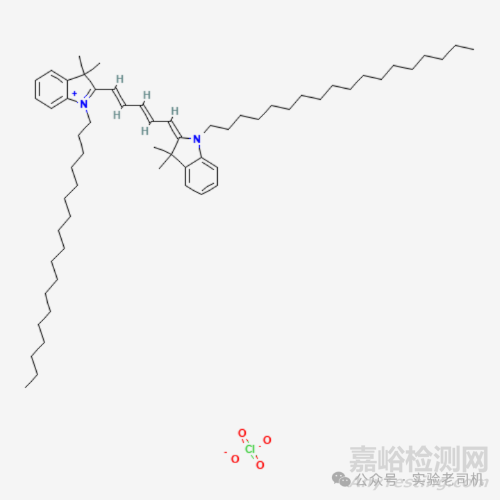
图1 DiD细胞膜荧光探针红色——C61H99ClN2O4化学式结构
(查询网址:https://pubchem.ncbi.nlm.nih.gov/compound/DiD-perchlorate)
2. 实验材料
1、样本&耗材:细胞、共聚焦皿/含爬片的6孔板、1.5mL EP管、tip头(10μL/200μL/1mL)
2、试剂:无血清细胞培养基、PBS缓冲液、4%多聚甲醛、Hoechst 33342染液
3、设备:荧光显微镜或共聚焦显微镜等
3. 实验操作
3.1 实验准备
1.细胞培养:将需要研究的细胞系(如肿瘤细胞、免疫细胞等)培养在合适的培养基中,置于37℃、5%CO₂的培养箱中培养,待细胞生长至对数生长期备用。
2.外泌体制备与标记外泌体制备:收集细胞培养上清液,通过差速离心、超滤、密度梯度离心或者试剂盒提取等方法分离提取外泌体,具体方法可根据实验需求和实验室条件选择。
3.DiD标记外泌体:按照DiD染料说明书,将适量的DiD染料与外泌体溶液混合,在37℃孵育4~6 h进行标记反应,使DiD染料嵌入外泌体的脂质膜中。标记完成后,通过超速离心或凝胶过滤等方法去除未结合的DiD染料,得到DiD标记的外泌体。
3.2 细胞处理
1.细胞接种:将状态良好细胞以合适的密度接种到直径20mm的共聚焦皿或含爬片的6孔板中,一般每孔接种细胞数为5×105~1×106个,根据细胞类型和实验需求调整。在培养箱中培养12~24 h,使细胞贴壁生长。
2.DiD标记的外泌体和细胞共孵育:将DiD标记的外泌体用无血清培养基稀释至合适浓度,例如终浓度为50-200 μg/mL,具体浓度可根据预实验结果调整。去除细胞培养板中的培养基,用PBS轻轻洗涤细胞2~3次后,加入含有DiD标记外泌体的无血清培养基,继续在培养箱中孵育。
3.摄取时间设置:根据实验目的设置不同的摄取时间点,如4 h、8 h、12 h、24 h等。在每个时间点结束时,进行后续操作。
4.细胞固定:孵育结束后,吸出含有外泌体的培养基,用PBS洗涤细胞3次,每次5 min,以去除未被摄取的外泌体。然后加入4%多聚甲醛固定细胞15 min,固定完成后,再用PBS洗涤细胞2~3次。
5.细胞核染色:向细胞中加入适量的Hoechst 33342染液,室温下孵育15 min,对细胞核进行染色。染色完成后,用PBS洗涤细胞3次,每次5 min,去除多余的Hoechst 33342染液。
6.荧光观察与拍照:使用荧光显微镜或共聚焦显微镜观察细胞,DiD标记的外泌体在合适的激发光下会发出红色荧光,Hoechst 33342染核后细胞核呈蓝色荧光。选择合适的视野,拍摄细胞摄取外泌体的图像,记录不同时间点细胞摄取外泌体的情况。
3.3 结果显示
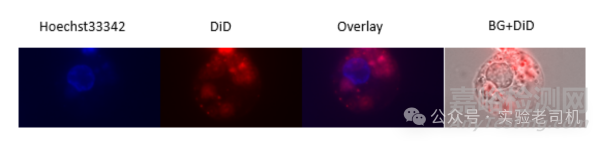
图2 外泌体进入细胞。BG:白光通道
Hoechst 33342荧光染料主要染色细胞核(Hoechst33342),而DiD与外泌体共孵育后,主要染色外泌体(DiD)。带红色荧光标记的外泌体与细胞共孵育后,可能会进入细胞质(Overlay),主要现象在BG+DiD组中体现。若设置时间拍摄可通过带荧光标记外泌体在胞质的滞留的量判断外泌体被细胞摄取的一个相对动态变化。
4. 注意事项
整个实验过程要保持无菌操作,避免细胞污染。
DiD染料标记外泌体时,要严格按照说明书操作,确保标记效率和标记的稳定性。
细胞接种密度和外泌体浓度的选择要合适,过低或过高都可能影响实验结果的观察和分析。
在荧光观察时,要注意选择合适的激发光和发射光波长,避免荧光信号的干扰。
实验应设置对照组,如只加入未标记外泌体的细胞组和只加入DiD染料的细胞组,以排除非特异性染色和其他因素的影响。
DiD染料具有很高的淬灭系数,偏光依赖性和很短的激发寿命,因此实验过程中注意避光。

来源:实验老司机旺旺仙贝


