您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2018-09-12 18:24
药监局公布飞利浦(中国)等3家企业召回存在质量问题的医疗器械产品,本次召回主要存在的问题分别为产品打印头没有固定在正确位置上,产品标签错误,在使用后其针尖保护装置不能将针尖完全套住三项问题。具体内容如下:

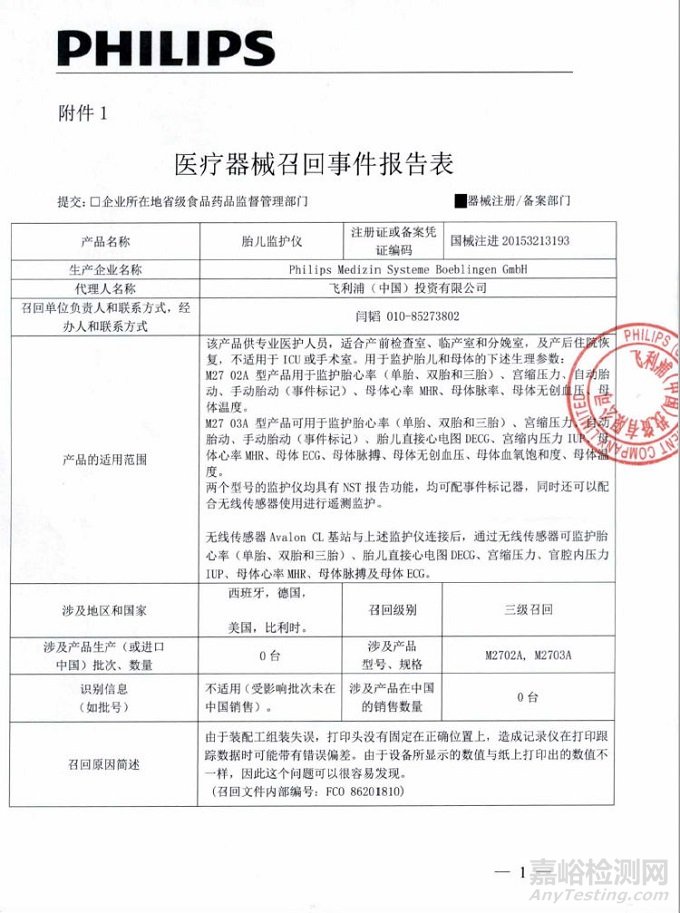
Philips Medizin Systeme Boeblingen GmbH对胎儿监护仪主动召回
飞利浦(中国)投资有限公司报告,由于产品打印头没有固定在正确位置上,造成记录仪在打印跟踪数据时可能有错误偏差,Philips Medizin Systeme Boeblingen GmbH对胎儿监护仪(注册证编号:国械注进20153213193)主动召回。召回级别为三级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
附件:医疗器械召回事件报告表
2018年9月10日
附件:

Smith & Nephew, Inc.对全膝系统主动召回
施乐辉医用产品国际贸易(上海)有限公司报告,由于产品标签错误,生产商Smith & Nephew, Inc.对全膝系统(注册证编号:国械注进20153463638)主动召回。召回级别为三级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
附件:医疗器械召回事件报告表
2018年9月10日
附件:

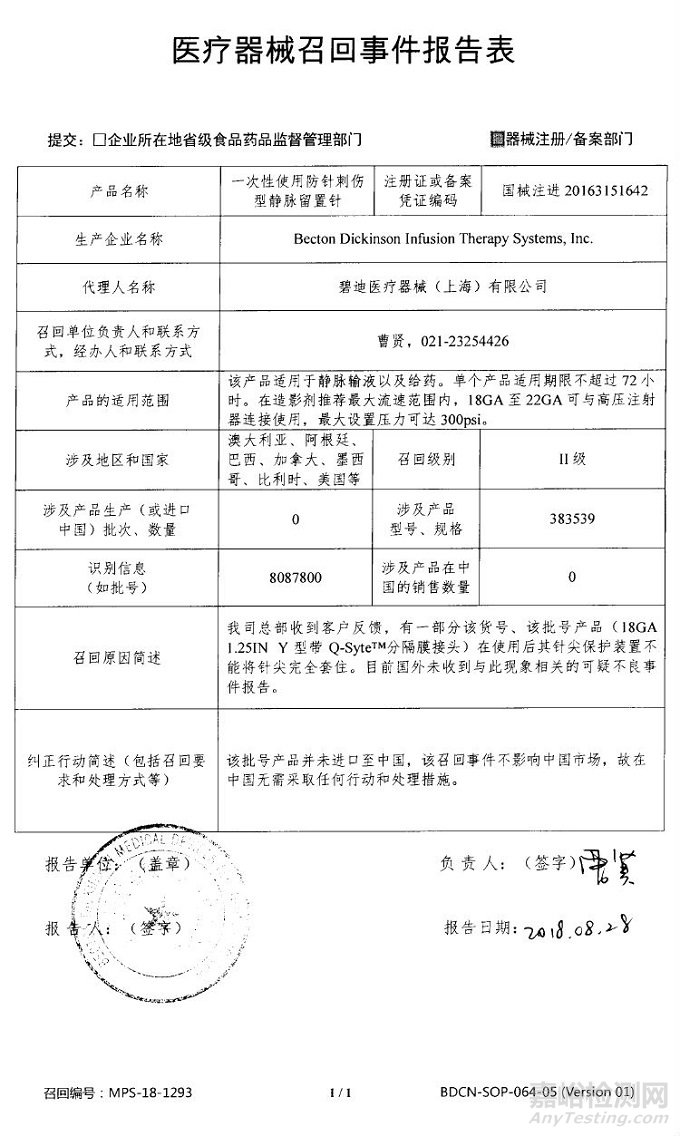
Becton Dickinson Infusion Therapy Systems, Inc.对一次性使用防针刺伤型静脉留置针主动召回
碧迪医疗器械(上海)有限公司报告,由于有一部分产品在使用后其针尖保护装置不能将针尖完全套住,生产商Becton Dickinson Infusion Therapy Systems, Inc.对一次性使用防针刺伤型静脉留置针(注册证编号:国械注进20163151642)主动召回。召回级别为二级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
附件:医疗器械召回事件报告表
2018年9月10日
附件:

来源:国家药监局