您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-07-29 09:33
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
携带PD-1抗体的病毒:亦诺微溶瘤病毒产品获批临床。亦诺微医药新一代重组疱疹溶瘤病毒产品T3011获国家药监局临床试验默示许可,T3011拟用于治疗局部晚期、复发或转移性实体瘤患者。T3011同时携带PD-1抗体和白介素12(IL12)的基因,经瘤内注射进入肿瘤组织,病毒在肿瘤内繁殖杀灭肿瘤细胞的同时,不断分泌产生PD-1抗体和IL12。据悉,该产品即将在澳洲、中国和美国开启临床研究,探索多种实体肿瘤的治疗。
国内药讯
1.富士胶片甲磺酸加诺沙星片获批进口中国。富士胶片株式会社旗下喹诺酮类口服合成抗菌药“T-3811”(甲磺酸加诺沙星片)获国家药监局核发的进口药品注册证。甲磺酸加诺沙星片以肺炎等呼吸器官感染症为主要适应症,对耐多药肺炎球菌等耐药菌也有抗菌活性。其具有较高的口服吸收性及向体内组织的转移性,一天仅需一次给药即可发挥疗效。预计将于2020财年正式开始销售。
2.罗沙司他两项中国Ⅲ期临床成功。阿斯利康首创的低氧诱导因子脯氨酰羟化酶(HIF-PH)抑制剂Roxadustat(罗沙司他)两项中国III期临床(806、808)结果积极。这两项试验旨在评估罗沙司他治疗慢性肾脏病引起贫血的中国患者的疗效。结果显示,罗沙司他达改善血红蛋白(Hb)效果的主要终点,与Epoetin alfa相比,使用罗沙司他治疗患者的改善时间比平均基线值延长23周至27周,获得了具有统计学意义的显著改善。详细数据发表在《新英格兰医学》杂志上。罗沙司他2018年12月已在中国获批用于透析依赖型慢性肾病患者相关的贫血。
3.创诺制药注射用培美曲塞二钠审批完毕。创诺制药注射用培美曲塞二钠的仿制4类申请办理状态变更为“审批完毕-待制证”,如果获批将视同通过一致性评价。注射用培美曲塞二钠为抗肿瘤药,原研药为礼来的力比泰。该品种国内获批的厂家有礼来、汇宇制药、豪森药业、齐鲁制药等。据米内网数据,2018年中国公立医疗机构终端培美曲塞销售额为53.82亿元。目前该品种通过一致性评价的企业仅有汇宇制药一家。
4.两款抗癌新药获批临床。CDE官网公示了最新的临床试验默示许可药品,包括石药中奇的SYHA1807胶囊及徐诺药业的对甲苯磺酸艾贝司他片。SYHA1807胶囊是石药中奇的1类抗癌新药,适应症为晚期小细胞肺癌。对甲苯磺酸艾贝司他片是一款治疗血液肿瘤和实体瘤的创新的组蛋白去乙酰化酶(HDAC)抑制剂,两个具体适应症为:既往接受过至少2种系统性治疗的复发难治滤泡性淋巴瘤(FL)以及既往接受过至少2次系统性治疗的复发难治弥漫性大B细胞淋巴瘤(DLBCL)。
5.中晟全肽完成A轮融资。中晟全肽生化完成一亿元人民币A轮融资。本轮融资由天士力资本旗下渤溢基金领投。中晟全肽是一家多肽先导药物发现的平台型企业。拥有自主知识产权的多肽全库。该公司多肽信息压缩技术可大幅降低了肽库构建的成本和新药筛选的成本,建库效率提高6000倍。此轮融资将用于其六肽库构建、多肽新药筛选平台优化及新药开发。当前,全球领域将多肽库用于新药发现的公司仅3家,包括PeptiDream和 Bicycle Therapeutics。
6.临床默示许可周年记:超600项IND获批。临床试验默示许可制度实施一年。截至7月26日16:00时,临床试验默示许可一栏已公示858项注册申请项目:申请临床的项目有669项(78%),补充申请为15.6%;超过65.2%为化学药品,生物制品为32.8%;新药申请703项(82%),其中国产新药有380项;858个项目中抗肿瘤产品最多(313项),占比超过36.5%,其中受理号最多的前五种癌症分别为:肺癌、乳腺癌、淋巴瘤、肝癌、胃癌;获临床默示许可药品数排名前三的企业为恒瑞医药(18)、诺华(16)和罗氏(11)。
国际药讯
1.Shield公司新型补铁药物Feraccru获FDA批准上市。Shield Therapeutics公司创新药Feraccru(ferric maltol,Accrufer)获FDA批准用于治疗成年铁缺乏症(iron deficiency)患者。Accrufer的活性成分是麦芽酚铁,一种非铁盐,稳定的新型化合物。Accrufer此前已在欧盟获批用于治疗铁缺乏症,并在瑞士获批治疗炎症性肠炎(IBD)相关的缺铁性贫血。一项AEGIS-H2H临床结果显示,与静脉输液补铁疗法相比,Accrufer达非劣效性标准。
2.杨森多发性硬化症新药达到Ⅲ期临床终点。强生旗下杨森拟用于治疗复发多发硬化症(MS)的在研疗法ponesimod Ⅲ期临床OPTIMUM结果积极。Ponesimod是一款特异性鞘氨醇-1-磷酸受体1(S1P1)调节剂。该研究旨在比较ponesimod与获批疗法teriflunomide在治疗复发型MS患者时的疗效、安全性和耐受性。试验结果表明,与teriflunomide相比,ponesimod达主要终点和多数次要终点。相关结果将在第35届欧洲多发性硬化症治疗和研究委员会大会(ECTRIMS)上公布。杨森计划在今年晚些时候递交其监管申请。
3.BMS公司PD-1/CTLA-4免疫组合疗法结果积极。百时美施贵宝(BMS)PD-1抑制剂Opdivo(nivolumab)与CTLA-4抑制剂Yervoy(ipilimumab)联用在治疗肿瘤PD-L1表达≥1%的非小细胞肺癌患者(NSCLC)的Ⅲ期临床试验(CheckMate 227)中达试验Ⅰa部分共同主要终点。该组合疗法显著提高NSCLC患者的总生存期(OS),且疗效优于化疗。针对Ⅰb部分中未表达PD-L1患者的探索性分析显示,Opdivo与低剂量Yervoy联用同样能为患者带来生存获益。相关结果将在未来的医学会议上公布。该组合疗法已获FDA批准一线治疗具有中高度风险的晚期肾细胞癌患者以及经治MSI-H/dMMR转移性结直肠癌患者。
4. “first-in-class"抗癌疗法获优先审评资格。Epizyme在研药物tazemetostat的新药申请获FDA受理,并获授予优先审评资格。Tazemetostat是一款“first-in-class”组蛋白赖氨酸甲基转移酶(Histone-Lysine N-methyltransferase)EZH2的抑制剂,拟用于治疗不适合手术治疗的转移/局部晚期上皮样肉瘤(epithelioid sarcoma)。该申请有望在2020年1月23号前得到批复。一项Ⅱ期临床结果显示,tazemetostat将肉瘤患者的客观缓解率达15%,疾病控制率达26%。中位总生存期尚未抵达。临床中,tazemetostat显示出良好的安全性和耐受性。
5.卫材公布淀粉样蛋白的相关性研究成果。卫材在2019年阿尔茨海默病(AD)协会国际会议(AAIC)上发布其最新研究,该研究在卫材和 Sysmex 公司联合开发的全自动免疫分析系统 HISCLTM*1系列中测量AD患者血液评估血浆和脑脊液(CSF)中淀粉样 (Beta)(A(Beta))的相关性,结果显示,血浆中 A(Beta)1- 42/A(Beta)1-4 的比值与脑脊液中 A(Beta)1-42/A(Beta)1-40 的比值之间存在相关性(斯皮尔曼等级相关系数(rs)*2=0.502, p<0.001),通过测量血浆中的 A(Beta)1-42/A(Beta)1-40的比值能够了解脑组织病变的进程。卫材计划检查血浆中 A(Beta)1-42/A(Beta)1-40的比值与淀粉样蛋白PET检查之间的相关性以评估其临床效用。
6.艾尔建/Editas启动眼科CRISPR疗法I/II期临床。艾尔建与Editas公司的眼科基因编辑疗法AGN-151587(EDIT-101)的I/II期临床研究BRILLIANCE(NCT03872479)已启动患者入组。该研究将在大约18例莱伯先天性黑蒙症10患者中评估AGN-151587的安全性、耐受性和疗效。AGN-151587是一种AAV5病毒载体,装载了3个成分,包括:由U6聚合酶III启动子控制的2个指导RNA(gRNA)gRNA-323和gRNA-64,以及通过光受体特异性GRK1启动子表达的金黄色葡萄球菌Cas9。这是全球第一款在人体内进行基因组编辑的CRISPR疗法的首个人体临床研究。
医药热点
1.悉尼科技大学宣布停收中医系新生。《悉尼先驱晨报》25日称,澳大利亚悉尼科技大学日前宣布,将于2020年起停止招收中医课程新生,引发百名师生及病人抗议。据称,校方此举可能是因该校科学院院长觉得西医才是正派,中医是没有科学根据的偏门医术。但校方发言人称,中医系与科学院的整体发展策略不符,加上财务状况不佳,才决定停止招收学生。
2.四川首个脑卒中“移动医院”成立。四川省首个移动车载CT脑卒中救护中心落户西南医科大学附属中医医院。据悉,移动车载CT脑卒中救护中心是针对急性缺血性脑卒中的一种新的规范化诊疗模式,以救护车为载体,装配小型移动CT、生化检验设备、生命监测设备、基本生命支持设备及5G网络系统,可在车上实现缺血性脑卒中的神经症状学检查、生命功能监测、CT诊断、静脉溶栓和远程会诊等“一站式”治疗。
3.恒瑞、正大天晴「阿比特龙片」定价公布。天津市医药采购中心发布恒瑞和正大天晴刚获批上市的前列腺癌治疗药物「醋酸阿比特龙片」的挂网价,分别为 12800 元/120 片/瓶、12200 元/120 片/瓶。阿比特龙是一种高选择性 CYP17 酶抑制剂,该药原研药(商品名:Zytiga)由强生开发,最早于 2011 年 4 月在美国上市,2015 年 5 月获批进口中国。目前,国内只有恒瑞和正大天晴的「醋酸阿比特龙片」获批上市。据悉,原研药泽珂在国内售价为 16268.40 元/120 片/瓶(250mg)。
股市资讯
.
上个交易日 A 股医药板块 +0.87%
涨幅前三 跌幅前三
尔康制药+10.00% 辅仁药业 -10.03%
莎普爱思 +9.97% 司 太 立 -9.38%
昆药集团 +8.66% *ST 仰帆 -4.97%
【复星医药】公司收到国家药品监督管理局签发的《临床试验通知书》,重组人促红素-HyFc 融合蛋白注射液用于治疗肾性贫血获准开展临床试验。
【陇神戎发】实现营业总收入1.1亿元元,与上年同期基本持平;归母净利润约804.30万元,同比下降24.69%;扣非归母净利润646.41万元,同比下降34.2%。
【云南白药】股东中国平安人寿保险股份有限公司计划减持本公司股份不超过38,322,099股(总股本比例不超过3%)。
审评动向
1. CDE最新受理情况(07月28日)
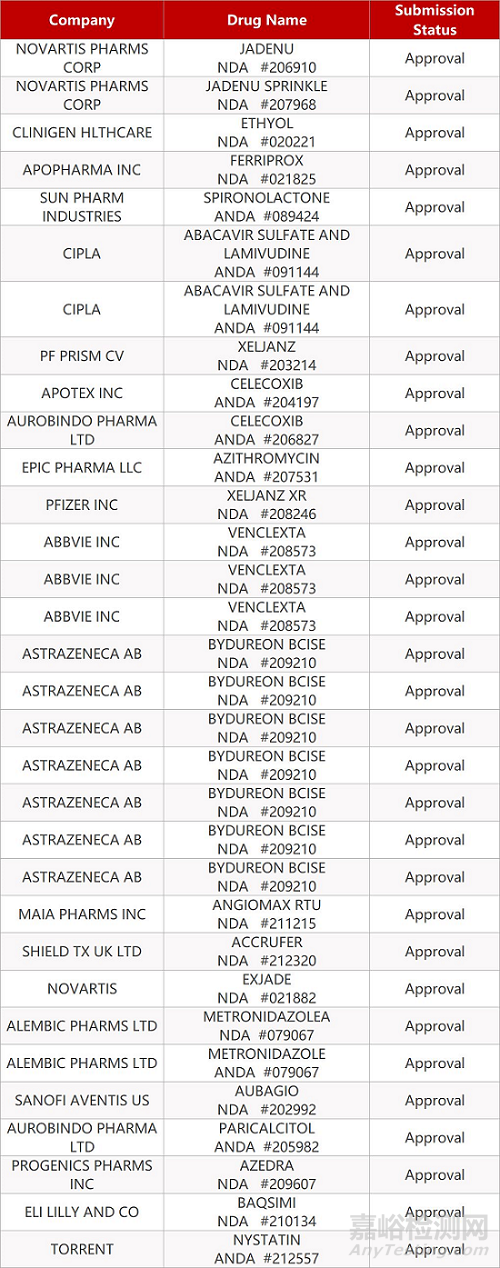
2. FDA最新获批情况(北美07月27日)


来源:药研发


