您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-12-02 09:45
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
奥拉帕利在华获批新适应症。阿斯利康与默沙东共同研发的PARP抑制剂奥拉帕利(Olaparib)审评状态更新为“审批完毕—待制证”,即将获批用于BRCA突变晚期卵巢癌患者的一线维持治疗。日前奥拉帕利已纳入国家医保乙类目录,用于无论是否携带BRCA突变的铂敏感复发性卵巢癌维持治疗。一项Ⅲ期临床SOLO-1结果显示,与安慰剂组相比,奥拉帕利一线维持治疗将接受含铂化疗后达到完全或部分缓解的BRCA突变晚期卵巢癌患者的疾病进展或死亡风险降低70%。经中位41个月随访后,奥拉帕利组未达到中位PFS值,而安慰剂组患者的中位 PFS为13.8个月。
国内药讯
1.正大天晴酒石酸阿福特罗申报上市。正大天晴3类仿制药酒石酸阿福特罗雾化吸入用溶液的上市申请获国家药监局受理。阿福特罗是一种长效β2受体激动剂,原研厂家为Sunovion制药,最早于2006年获FDA批准,用于治疗慢性阻塞性肺病(COPD),商品名为Brovana 。2017年,Brovana销售额大约为3亿美元。目前,国内申报酒石酸阿福特罗雾化吸入用溶液的厂家有正大天晴、嘉林药业和长泰药业3家,除正大天晴外,其余两家尚处于临床阶段。
2.骁悉®狼疮性肾炎适应症国内获批。罗氏旗下口服药物骁悉®(CellCept®,吗替麦考酚酯)狼疮性肾炎适应症于10月30日正式在国内获批。骁悉®也成为目前国内唯一获批治疗狼疮性肾炎的吗替麦考酚酯。与我国狼疮性肾炎治疗方案(皮质类固醇联合环磷酰胺或硫唑嘌呤的非选择性免疫抑制剂的组合)相比,骁悉®毒副作用较轻。据悉,骁悉®1997年进入中国,已先后获批用于治疗接受同种异体肾脏或者肝脏移植患者中预防器官的排斥反应。
3.恒瑞吡咯替尼临床申请获默示许可。恒瑞医药马来酸吡咯替尼片获国家药监局临床试验默示许可,联合曲妥珠单抗及多西他赛,拟用于治疗表皮生长因子受体2(HER2)阳性早期或局部晚期乳腺癌患者的新辅助治疗。吡咯替尼(艾瑞妮)是一款不可逆性HER2/EGFR双靶点的酪氨酸激酶抑制剂,于2018年8月已获NMPA有条件批准,联合卡培他滨,用于治疗HER2阳性、既往未接受或接受过曲妥珠单抗的复发或转移性乳腺癌患者(使用本品前患者应接受过蒽环类或紫杉类化疗)。目前该药已被纳入国家医保乙类目录。
4.宜明昂科CD20/CD47双抗药物获批临床。宜明昂科自主研发的CD47/CD20双特异性抗体(IMM0306)获国家药监局的临床试验默示许可。IMM0306是一种同时靶向CD47和CD20的抗体-受体重组蛋白,能同时作用于肿瘤疾病靶点和调节免疫系统,通过靶向免疫调节靶点CD47解除“别吃我”信号,通过Fc介导的ADCC/ADCP激活NK细胞及巨噬细胞从而发挥强大的肿瘤免疫治疗效应,通过和肿瘤细胞表面的CD20结合而避开与正常组织CD47的结合从而减低CD47靶点相关毒性。
5.复星医药白血病新药FN-1501获孤儿药认定。复星旗下在研酪氨酸激酶抑制剂FN-1501获FDA授予治疗急性髓性白血病的孤儿药资格。该新药为复星医药经中国药科大学转让、后续自主研发的创新型小分子化学药物,主要用于白血病治疗。目前,该新药用于治疗白血病、实体瘤于美国、澳大利亚、中国境内处于I期临床阶段。截至日前,于全球上市的与该新药同靶点(FLT3)的新药有诺华的Midostaurin、安斯泰来的Gilteritinib,于中国境内尚无同靶点的药物获批上市。根据IQVIAMIDASTM最新数据,2018年度Midostaurin和Gilteritinib全球销售额约为12,788万美元。
国际药讯
1.小野制药在日本提交Opdivo补充申请。小野制药在日本提交抗PD-1单抗Opdivo(欧狄沃,nivolumab,纳武单抗)的一份补充申请,要求在当前批准的适应症中,在当前“静脉输注每2周一次240毫克,每次持续30分钟”剂量和给药时间表基础上增加“静脉输注每4周一次480毫克,每次持续30分钟”。小野制药是Opdivo的最初研发者,Opdivo于2014年7月在日本率先获得批准,是全球获批的首款PD-1免疫疗法,治疗适应症为黑色素瘤。目前Opdivo在日本获批的适应症包括非小细胞肺癌、肾细胞癌、霍奇金淋巴瘤、头颈部癌、胃癌、恶性胸膜间皮瘤等。
2.阿斯利康Imfinzi获FDA优先审评资格。阿斯利康(AstraZeneca)公司PD-L1抑制剂Imfinzi(durvalumab)用于治疗先前未接受过治疗的广泛期小细胞肺癌患者的补充申请获FDA受理,并获授予优先审评资格。预计FDA将在明年第一季度结束前做出批复。一项Ⅲ期临床CASPIAN结果显示,Imfinzi联合标准化疗能显著延长患者的总生存期(OS),将患者的死亡风险减少27%,中位OS为13.0个月,而标准化疗的对照组其数据为10.3个月。在治疗的18个月后,治疗组有33.9%依旧存活,这一数字在对照组为24.7%。
3.Zogenix公司Fintepla获优先审评资格。Zogenix公司在研口服低剂量氟苯丙胺Fintepla(ZX008)的新药上市申请获FDA受理,治疗与Dravet综合征相关的癫痫发作。FDA同时授予其优先审评资格,预计在明年3月25日之前作出回复。ZX008此前已获FDA和欧盟授予的孤儿药资格、FDA授予的突破性疗法认定。一项关键性Ⅲ期临床结果显示,与安慰剂组相比,Fintepla将每月平均出现痉挛性癫痫发作的次数减少54.7%(p<0.001)。
4.Verrica公司软疣治疗药物VP-102上市申请获受理。Verrica公司药物-设备组合产品VP-102(cantharidin,斑蝥素,0.7%外用溶液)的新药申请获FDA受理,VP-102有望成为美国首个获批治疗传染性软疣的药物,指定的PDUFA目标日期为2020年7月13日。两项III期试验(CAMP-1和CAMP-2)结果显示,与安慰剂组相比,VP-102治疗组在所有可治疗的软疣病变实现完全清除的患者比例具有统计学意义的显著提高。两项试验中,VP-102耐受性良好,在接受VP-102治疗的受试者中未报告严重不良事件。
5.Y-mAbs公司GD2抗体naxitamab美国申请上市。Y-mAbs公司宣布,已在FDA的滚动审评程序中,提交其靶向GD2抗原的人源化单抗naxitamab治疗复发/难治性高危神经母细胞瘤上市申请的第一部分。该药此前已获FDA授予治疗神经母细胞瘤和骨肉瘤的孤儿药资格,以及联合GM-CSF治疗高危神经母细胞瘤的突破性药物资格。一项I/II期12-230研究(NCT01757626)的最新数据显示,naxitamab联合GM-CSF治疗复发/难治性高危神经母细胞瘤儿童患者的客观缓解率为78%、有50%的患者无进展生存期达到24个月。
6.两种抗体疗法显著降低埃博拉感染死亡率。Ridgeback Biotherapeutics公司评估单抗药物mAb114治疗埃博拉感染的临床研究Pamoja Tulinde Maisha(NCT03719586)的积极结果已发表于《新英格兰医学杂志》(NEJM)上。患者分别接受3种抗体疗法(抗体鸡尾酒ZMapp、三种单抗混合物REGN-EB3[再生元]、单克隆抗体mAb114)和一款抗病毒药物remdesivir(吉利德)的治疗,治疗28天的结果显示,接受REGN-EB3和mAb114治疗的受试者比其他两组受试者有更大的生存机会。ZMapp、remdesivir、mAb114、REGN-EB3各治疗组感染者死亡率分别为49.7%、53.1%、35.1%、33.5%。mAb114此前已获FDA授予了孤儿药资格和突破性药物资格。
医药热点
1.网曝饶毅举报学术造假,本人回应:有过草稿,没有发出。网上忽传饶毅教授向国家自然科学基金委实名举报三位同行论文造假一事引发舆论关注。据最新报道,饶毅教授回应,这是一份尚未发出的草稿,国家自然科学基金委表示“正在了解相关情况”。首都医科大学校长、北大生命科学学院终身讲席教授饶毅在这封实名举报信中,举报武汉大学医学院李红良多年持续学术造假;中科院上海生命科学研究院生化细胞所研究员裴钢1999年发表的论文中,3张图不真实,存在造假嫌疑;上海药物所耿美玉研究员(即阿尔兹海默GV971中国首款该类药物主要研究者、论文通讯作者)论文造假。
2.疫苗企业巡查未发现严重问题。国家药监局发布消息称,今年5月~10月,该局共派出36个检查组,组织检查员197人次,对所有在产的36家疫苗生产企业开展了巡查,重点检查企业质量管理、生产管理、质量控制等情况,巡查未发现严重违法违规生产行为。据悉,在2019年疫苗生产企业巡查工作整改推进会上,来自全国46家疫苗生产企业的法定代表人、企业负责人、质量负责人等参加了《疫苗管理法》知识考试,相关药监部门与生产企业签署了落实整改和加强监管责任书。
3.全国报告存活艾滋病感染者95.8万。12月1日是第32个“世界艾滋病日”,国家卫健委30日发布消息称,截至2019年10月底,全国报告存活艾滋病感染者95.8万例,性传播成为当前主要传播途径。数据显示,2019年1月至10月,全国共检测2.3亿人次,新报告发现感染者13.1万例,新增加抗病毒治疗12.7万例,全国符合治疗条件的感染者接受抗病毒治疗比例为86.6%,治疗成功率为93.5%。整体疫情持续处于低流行水平。
【健友股份】依诺肝素钠注射液USP获得美国FDA批准,该产品用于预防静脉血栓栓塞性疾病(预防静脉内血栓形成),特别是与骨科或普外手术有关的血栓形成。
【赛升药业】子公司赛而生物收到北京市市场监督管理局出具的《行政处罚决定书》,因生产标签、说明书不符食品安全法规定,没收违法生产经营的食品赛而牌天葡片418盒,罚款合计5.71万元。
审评动向
1. CDE最新受理情况(12月02日)
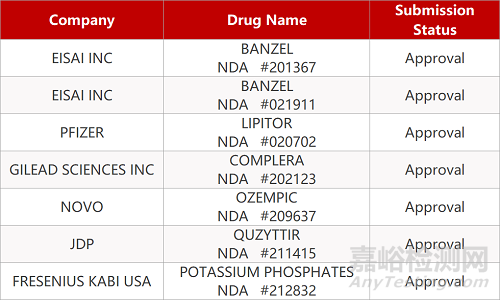
2. FDA最新获批情况(北美11月29日)


来源:药研发


