您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-06-05 10:03
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:14条资讯,阅读时长约:3分钟 」
今日头条
尼达尼布在华第二项适应症即将获批。勃林格殷格翰(Boehringer Ingelheim)TKI抑制剂尼达尼布(nintedanib,Ofev)在中国提交的新适应症上市申请审评状态变更为“在审批”,如若顺利,尼达尼布即将在中国迎来第二项适应症:系统性硬化病相关间质性肺疾病(SSc-ILD)。基于一项Ⅲ期临床SENSCIS的阳性结果,该药用于SSc-ILD适应症于去年在华实现注册申请全球同步递交。在这项研究中,尼达尼布将患者肺功能下降率降低了44%。尼达尼布2017年9月已在华获批治疗特发性肺纤维化,商品名维加特。目前该药的第三项新适应症上市申请已获CDE受理。
国内药讯
1.齐鲁注射用醋酸卡泊芬净申报上市。齐鲁制药4类仿制药注射用醋酸卡泊芬净上市申请获CDE受理。注射用醋酸卡泊芬净是一种全身用抗真菌药,用于治疗中性粒细胞减少、伴发热病人的可疑真菌感染,以及治疗对其他治疗无效或不能耐受的侵袭性曲霉菌病人。2019年中国公立医疗机构终端注射用醋酸卡泊芬净销售达22.3亿元,其中原研厂家默沙东占据84.57%的市场份额,恒瑞医药占据15.25%的市场份额。
2.徐诺药业mTORC抑制剂Ⅰ期临床结果发表。徐诺药业在国际知名期刊Cancers上发表第三代mTORC1/2抑制剂XP-105的Ⅰ期临床数据。该研究评估XP-105单药、XP-105联合依西美坦、以及XP-105联合紫杉醇治疗晚期实体瘤的效果。结果显示:XP-105耐受性良好,三个治疗组的疾病控制率分别为20%、28%和58%。其中XP-105联合紫杉醇在20例可评估患者中达到70%的疾病控制率;剂量限制性毒性(DLT)和与治疗相关的不良事件均与其他mTOR抑制剂治疗晚期实体瘤的报道一致;单药和联合治疗方案均显示出良好的抗肿瘤活性,联合用药组还达到了客观缓解。
3.塔吉瑞生物新一代Bcr-Abl抑制剂获批临床。塔吉瑞生物1类新药TGRX-678片在中国获得两项临床试验默示许可。TGRX-678是一款靶向作用于Bcr-Abl融合基因的第四代酪氨酸激酶抑制剂,拟开发用于治疗慢性粒细胞白血病患者。TGRX-678片采用新颖的治疗方案,不仅能解决第一、二代耐药、第三代副作用大的问题,还有望通过长期无治疗缓解获得功能性治愈慢粒白血病。本次是TGRX-678片首次获批临床。
4.凌腾医药双特异性抗体获批临床。凌腾医药CD3/EpCAM双特异性抗体catumaxomab注射液(卡妥索单抗注射液)在中国获批两项临床试验默示许可,临床适应症为不适合接受全身治疗的、伴腹膜转移的晚期胃癌治疗。据悉,Catumaxomab由Horst Lindhofer博士(凌腾医药的联合创始人)发明,该药曾在2009年获得EMA批准在欧洲上市治疗恶性腹水,是全球首个上市的双特异性抗体。该药由于上市后表现欠佳于2017年退市停产。
5.微芯生物JAK抑制剂CS12192胶囊获批临床。微芯生物1类新药JAK抑制剂CS12192胶囊获国家药监局临床试验默示许可,适应症为类风湿性关节炎。CS12192是微芯生物自主研发的已获全球化合物发明专利授权的高选择性JAK3激酶抑制剂,同时部分抑制JAK1和TBK1激酶,目前尚没有此类抑制剂药物上市。在临床前研究中,CS12192已在类风湿性关节炎、多发性硬化病、系统性红斑狼疮、银屑病等自身免疫性疾病模型及移植物抗宿主疾病(GVHD)模型上显示出明显的药效活性。
国际药讯
1.世卫组织决定恢复羟氯喹抗新冠病毒试验。在5月25日通报暂时叫停羟氯喹抗新冠病毒试验后,世卫组织3日宣布,基于现有患者病亡率数据,世卫组织决定恢复羟氯喹抗新冠病毒试验。世卫组织首席科学家斯瓦米纳坦强调,目前使用羟氯喹治疗新冠肺炎尚存许多“未知”,只有通过临床试验尤其是规范的随机试验才能得到确切答案,因此世卫组织鼓励继续进行羟氯喹抗新冠病毒试验,同时将密切监控试验安全性数据,未来不排除再度对试验进行调整。
2.Y-mAbs公司创新GD2抗体获FDA优先审评资格。FDA受理Y-mAbs公司为GD2抗体naxitamab递交的生物制品许可申请(BLA),并授予其优先审评资格,用于治疗复发/难治性高危神经母细胞瘤患者。预计11月30日前做出回复。在一项Ⅰ/Ⅱ期临床(12-230)中,naxitamab联合GM-CSF治疗在不适合化疗的复发/难治神经母细胞瘤儿童患者中达到78%的客观缓解率(ORR),并使50%的患者无进展生存期(PFS)达到24个月;在接受化疗但效果不佳的患者中,该组合疗法也达到37%的ORR,并使36%的患者PFS达到24个月。
3.罗氏公布TIGIT抗体组合疗法的临床研究结果。罗氏(Roche)在ASCO年会上报告了TIGIT抗体tiragolumab与PD-L1抑制剂联用,治疗转移性非小细胞肺癌(NSCLC)患者的Ⅱ期临床结果。在中位随访为10.9个月时,这一组合在PD-L1阳性(TPS>1%)患者中达到37%的客观缓解率(ORR),优于安慰剂与Tecentriq的组合(21%);在PD-L1高表达的亚组(TPS>50%)中,这一组合的效果更佳,ORR达到66%。接受组合疗法的患者中,PD-L1阳性患者的无进展生存期(PFS)为5.55个月,而PD-L1高表达患者的中位PFS尚未达到。目前罗氏已启动Ⅲ期临床在PD-L1高表达的NSCLC患者中验证这一结果。
4.辉瑞JAK1抑制剂第二项单药III期研究达双重终点。辉瑞口服JAK1抑制剂abrocitinib治疗特应性皮炎第二项关键单药III期研究(JADE MONO-2)结果积极。数据与首个单药III期研究(JADE MONO-1)一致,达所有共同主要终点和关键次要终点。与安慰剂组相比,接受abrocitinib治疗的患者中,获得IGA(O/1)≥2、EASI-75、PP-NRS≥4、EASI-90应答的患者比例更高,200mg和100mg两组达上述指标的患者比例分别为38.1%和28.4%,61.0%和44.5%,55.3%和45.2%,37.7%和 23.9%,而安慰剂组这些数值分别仅有9.1%、10.4%、11.5%、3.9%。辉瑞计划在今年晚些时候向FDA提交其新药申请。
5.礼来公布Taltz治疗PsA头对头研究长期结果。礼来公布IL-17A拮抗剂Taltz(ixekizumab)Ⅲb/ Ⅳ期临床SPIRIT的亚组SPIRIT-H2H的研究结果。该试验在活动性银屑病关节炎(PsA)患者中评估Taltz单药或与甲氨蝶呤(MTX)或其他csDMARD(常规合成的疾病改善抗风湿药物)联用相对于Humira(adalimumab)的疗效,结果显示,单药亚组中,与Humira相比,Taltz组达到最小疾病活动(MDA)的患者比例更高(49%VS. 33%);联用MTX亚组中,Taltz和Humira组达MDA的比例为47%和 47%;联用csDMARD时,两组比例为47%和44%。三个亚组中,与Humira相比,使用Taltz的患者中同时达到ACR50和PASI 100的比例更高,单药组:38%vs19%,联用MTX:39%vs30%,联用csDMARDS:40%vs29%。
6.再生元拟扩展与Intellia Therapeutics的研发合作。再生元和Intellia Therapeutics宣布扩展现有的合作。双方将共同开发治疗A型和B型血友病的基因编辑疗法。再生元同时获得开发靶向额外治疗靶标的基因编辑疗法的权益,以及独立开发和商业化离体基因编辑产品的非排他性权益。Intellia将获得7000万美元的前期付款,再生元将对Intellia进行3000万美元的额外股权投资。在临床前研究中,利用Intellia公司的CRISPR/Cas9基因编辑平台,两家公司成功将转基因靶向插入实验动物的肝脏细胞的基因组中,这些动物已产生了正常或更高水平的循环人凝血因子IX(B型血友病患者体内缺失或缺陷的一种凝血蛋白)。
医药热点
1.测污水核酸含量可知病毒传播情况。芬兰国家卫生与福利研究所2日表示,初步研究结果显示,污水中的新冠病毒核糖核酸含量,基本可以反映病毒在特定地区的传播情况。据了解,芬兰在全国多个地方都进行了污水分析,但仅在芬兰南部人口密集的赫尔辛基和图尔库两座城市的污水中发现了达到有效研究样本数的新冠病毒核糖核酸,与两座城市的病毒感染情况基本相符。其中,首都赫尔辛基污水中发现的病毒核糖核酸数量远高于图尔库,而赫尔辛基正位于芬兰的疫情中心乌西玛大区。
2.天津卫健委等28部门联合惩戒医闹医暴行为。天津市卫健委联合27个部门起草《关于对严重危害正常医疗秩序的失信行为责任人开展联合惩戒的实施方案(征求意见稿)》。《方案》规定的惩戒对象非常明确,就是“实施或参与涉医违法犯罪活动,被公安机关处以行政拘留以上处罚,或者被司法机关追究刑事责任的严重危害正常医疗秩序的自然人”,其中,涉医违法犯罪活动主要包括在医疗机构内故意伤害医务人员、损毁公私财物等六种情形。
股市资讯
【健康元】公司董事会审议同意本公司及下属子公司继续开展远期外汇衍生品交易业务,主要包括远期结售汇及相关组合业务,交易金额不超过20亿元人民币。
【康惠制药】公司拟作为有限合伙人以自有资金出资200万元人民币,投资参与设立嘉沣合伙,出资比例6.65%。
【片仔癀】公司以竞买起始价12,750万元的价格竞得漳州市高新区2020G02的地块,并与漳州市自然资源局签订了《国有建设用地使用权出让合同》。
审评动向
1. CDE最新受理情况(06月04日)
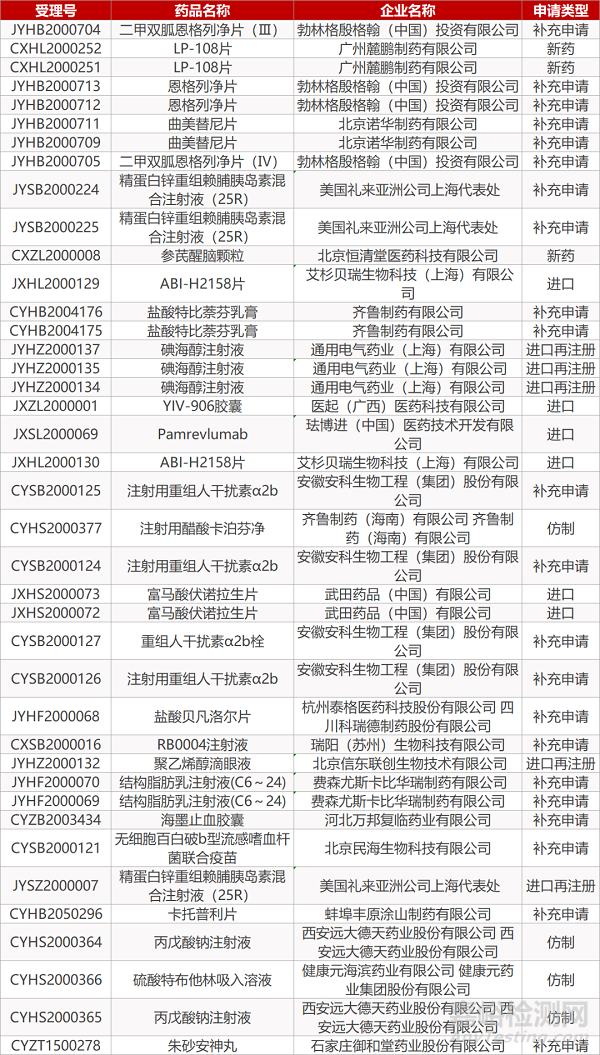
2. FDA最新获批情况(北美06月02日)
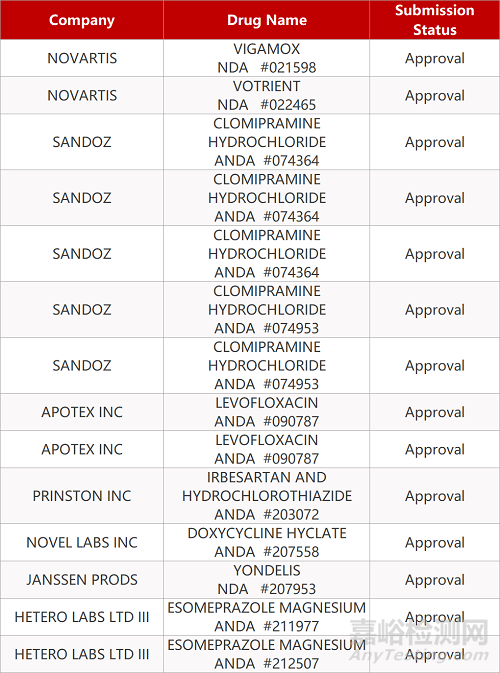
- The End -

来源:药研发


