您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-07-17 17:07
近日,国家药监局发布《视力筛查仪注册技术审查指导原则(征求意见稿)》,全文如下
视力筛查仪注册技术审查指导原则(征求意见稿)
本指导原则旨在指导注册申请人对视力筛查仪产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是对视力筛查仪的一般要求,申请人应依据产品的具体特性确定相关内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围
本指导原则适用于视力筛查仪,不适用于验光仪(包括:台式验光仪和手持式验光仪)。应关注,验光仪与视力筛查仪的原理不同,因此产品的设计要素和应用方式有差异,应区分考量。验光仪可参照《验光仪注册技术审查指导原则》。
视力筛查仪指用于视力筛查工作的,不用于临床诊断的,能够提供球镜度、柱镜度和柱镜轴向这类屈光测试基本参数的仪器。
视力筛查仪在《医疗器械分类目录》(总局2017年第104号公告)中,管理类别为第II类,产品分类编码为16-03-01。
二、技术审查要点
(一)产品名称
产品的命名应符合《医疗器械通用名称命名规则》的要求。视力筛查是目前国际通用的促进视健康的一种方式。结合产品的特点及当前普遍使用的表述方式,建议名称表述为:视力筛查仪。
应注意,视力筛查仪由于其应用特点,通常为手持式设备,因此,无需在名称中加入“手持式”限定。验光仪有台式和手持式之分。手持式验光仪与视力筛查仪是不同的两种器械,在名称上可以区别开来。
名称中不体现“婴幼儿”、“儿童”等适用人群的信息。相关信息可体现在产品适用范围及使用说明书中。
名称中无需加入“可视化“之类的词汇,结合市场同类产品的普遍特性,均包含显示器,并不作为产品特性。
(二)产品主要结构及功能
1.产品结构组成
视力筛查仪通常由主机、电源适配器和电源线组成。通常是双目测量。其中主机通常包含镜头、电路板(含测试及指示光源)、显示屏、电池、光学镜片、保护外壳。典型产品结构如下图:
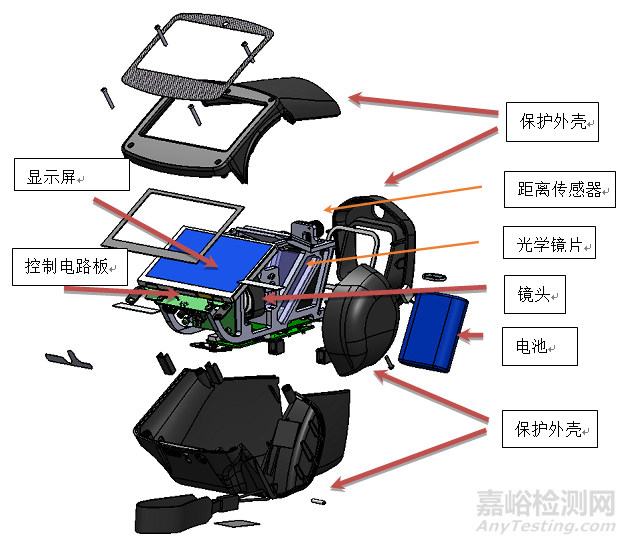
图1 产品结构图示
2.产品主要部件功能
镜头:眼部图像信息的获取。
光学镜片:构成测试光路的主要组成部分。
距离传感器:感知器械测试端与被测人眼合适的测试距离。
电路板:信息采集处理、功能控制、数据运算的核心器件。采集处理镜头获取的图像;控制测量光及指示光光源;数据运算。
显示屏:用户交互界面。指令输入及结果输出的媒介。通常采用触摸屏。
电池仓及电池:一般采用可充电锂电电池,可作为内部供电电源。
(三)工作原理
视力筛查仪的典型产品采用“偏心摄影验光原理”,采用在一定距离处(例如:85cm)拍摄眼睛图像的方式,基于人眼屈光异常会导致不同程度的影像显示的明暗差异,经过测量和运算得出反映屈光状态的指标,是一种客观验光方法。可测试球镜度、柱镜度和柱镜轴向,部分产品还可测量瞳孔大小和瞳孔距离。球镜度、柱镜度和柱镜轴向是临床上反映屈光状态的主要参数。有的设备具有显示“等效球径度”这个指标的功能,它是球径度和柱镜度的综合衡量指标。
(四)注册单元划分的原则
视力筛查仪与验光仪,包括手持式验光仪应划分为不同注册单元。原则上,同样采用偏心摄影验光原理的视力筛查仪可划分为同一注册单元。
(五)产品适用标准情况
应适用的强制性标准:GB 9706.1-2007《医用电气设备第1部分:安全通用要求》、YY 0505-2012《医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容要求和试验》。应适用的眼科器械通用标准:ISO 15004-1:2006《眼科仪器基本要求和试验方法第1部分:适用于各类眼科仪器的一般要求》、ISO 15004-2:2007《眼科仪器基本要求和试验方法第2部分:光危害的防护》。应参考引用的标准YY 0673-2008《眼科仪器验光仪》、GB/T14710-2009《医用电气环境要求及试验方法》。根据产品的实际情况,在性能研究中可适用其他标准,此处不罗列。
应注意,YY 0673是验光仪的专用产品标准,视力筛查仪应引用该标准,在具体指标的确定方面不要求完全符合标准,但应有科学、合理的原因,并在研究资料中提交充分的验证资料。
(六)产品的适用范围/预期用途
视力筛查仪用于筛查和评估人眼的屈光状态,必要时,需到医疗机构进行进一步的诊断和治疗。可测量人眼的球径度、柱镜度和柱镜轴向,等效球径度,瞳孔大小(如适用)、瞳距(如适用)。
如有针对特定年龄阶段人群应用,应在适用范围中明确。
补充说明:验光仪的适用范围是用于屈光测试,可用于临床诊断,这是与视力筛查仪在适用范围上的本质区别。
(七)产品的主要风险
视力筛查仪的风险分析结合产品实际情况制定,应关注以下几个方面:
(八)产品的研究要求
1.性能研究
可参照相关标准及产品自身特点制定,可参考本指导原则(五)产品适用标准部分。应注意,产品性能参数的制定需提交依据及相关验证资料。
2.生物相容性研究
不适用。视力筛查仪在距人眼一定距离处拍照测量,预期不与被检者接触,与使用者为皮肤接触。
3.灭菌和消毒工艺研究
不适用。应明确产品适用的清洁方式,并在随附文件中清晰说明。
4.有效期和包装
应按照《有源医疗器械使用期限技术审查指导原则》提交使用期限的验证资料。应采用合适的包装方式并进行说明。该产品不涉及医用无菌包装。
视力筛查仪作为一种光学类的电子产品,在考量使用期限时除了电子元器件的寿命,还需考量光学元件的使用期限。
5.软件
应按照《医疗器械软件注册技术审查指导原则》提交软件研究资料。该产品一般软件分级为A类。
应按照《医疗器械网络安全注册技术审查指导原则》提交网络安全研究资料。视力筛查仪一般具有患者数据的导入和导出的功能。患者数据库通常可通过USB接口导出。
(九)产品技术要求的主要性能指标
应符合《医疗器械产品技术要求编写指导原则》,示例见附录I。
(十)产品的临床评价要求
视力筛查仪尚未列入免于进行临床试验的产品目录中。该目录中已列入验光仪(16-03-01),视力筛查仪产品原理、结构组成和适用范围与验光仪均有差异,故不属于该目录。
按照《医疗器械临床评价技术指导原则》,可采用“通过同品种医疗器械临床试验或临床使用获得的数据进行分析评价要求”路径进行评价,具体方法见相关文件。
在与同类产品进行比对的过程中,在符合上述指导原则的基础上,应关注产品原理、光输出波长及能量范围、性能参数及使用方式的对比。
(十一)产品说明书和标签要求
应符合《医疗器械说明书和标签管理规定》(总局令第6号)要求。应符合产品适用的强制性标准中对于说明书的要求,例如:符合GB9706.1和YY0505中对于说明书内容的要求;建议参考ISO15004-2中第七章的要求此外,应关注下述内容:
三、审查关注点
上述每个要点的详细内容可参考本指导原则第二部分:技术审查要点。
四、编写单位
国家药品监督管理局医疗器械技术审评中心
五、参考文献
[1] 中共中央国务院.“健康中国2030”规划纲要[EB/OL]. (2016-10-25)[2020-03-16]. http://www.gov.cn/zhengce/2016-10/25/content_5124174.htm
[2] 王维. SureSight 视力筛查仪在大面积儿童屈光度异常筛查中的意义[J]. 生物医学工程与临床,2015,19(6):616-617.
[3] 康映红等. SureSight 手持式自动验光仪筛查儿童屈光异常分析[J]. 昆明医科大学学报,2013,(7):89-91.
[4] 国家卫生健康委办公厅. 关于印发儿童青少年近视防控适宜技术指南的通知: 国卫办疾控函〔2019〕780号[EB/OL]. (2019-10-14)[2020-03-16]. http://www.nhc.gov.cn/jkj/s5898bm/201910/c475e0bd2de444379402f157523f03fe.shtml
[5] 娄斌等. 新版美国眼科学会《儿童眼评估临床指南》解读 [J]. 中国斜视与小儿眼科杂志,2019,27(3):37-38
[6] 国家卫生健康委员会.中小学生屈光不正筛查规范: WS/T 663-2020[S].
[7] 国家药品监督管理局医疗器械技术审评中心. 验光仪注册技术审查指导原则:2017年第198号公告[EB/OL]. (2017-12-06) [2020-03-16]. https://www.cmde.org.cn/CL0112/6923.html
[8] 全国光学和光学仪器标准化技术委员会医用光学和仪器分技术委员会. 眼科仪器验光仪:YY 0673-2008 [S]. 北京:中国标准出版社,2009:2-3.
[9] Ibrahim Tuncer. Comparison of the Retinomax hand-held autorefractor versus table-top autorefractor and retinoscopy[J]. Int J Ophthalmol, 2014.
[10] 李军,汪芳润. 儿童眼病照相普查法-摄影验光法的应用进展[J]. 中国斜视与小儿眼科杂志,1999,7(2):99-104.
[11] 杨军等. 数码摄影验光法在学龄前儿童屈光状态调查中的应用[J]. 中国现代药物应用,2012,6(22):133-134.
[12] 张振永 褚仁远. 偏中心摄影验光法在学龄前儿童屈光状态普查中的应用[J]. 上海医学,1999,22(5):294-297.
[13] 陶利娟. 摄影验光法在婴幼儿眼病与屈光异常普查中的应用[J]. 中国斜视与小儿眼科杂志,2004,12(2):69-71.
[14] 黄立红 顾芳. 摄影验光法在学龄前儿童弱视普查中的意义[J]. 中国斜视与小儿眼科杂志,2001,9(4):177-180.
[15] 张红等. 数码摄影验光法在婴幼儿眼病与屈光异常普查中的应用[J]. 实用医学杂志,2008,24(5):765-766.
[16] 车骏. 手持式视力筛查仪和自动电脑验光仪在青少年屈光检查中的应用价值研究[J].科技风,2017(08):257-258.
[17] 赵菁. 视力筛查仪在儿童视力筛查中的应用[J]. 医疗装备,2018,31(352):12-13.
[18] 陶荣等. 学龄前儿童弱视筛查方法比较[J]. 中国斜视与小儿眼科杂志,2018, 26(2):37-38+40.
[19] 高丽娟. 视力筛查仪应用于儿童眼保健中的价值研究[J].现代诊断与治疗,2018,29(268):2593-2595.
[20]余继峰等. Spot Vision Screener视力筛查仪在儿童视力筛查中的应用分析[J]. 国际眼科杂志,2015,15(7):1285-1286.
[21]吴良成等. 国产手持式视力筛查仪在学龄前儿童弱视筛查中的效果[J]. 中华眼科医学杂志,2014(2):26-29.
[22]张德明等.Suresight视力筛查仪在学龄前儿童屈光状态检查中应用分析[J]. 当代医学,2010,16(18):152.
[23]戴炳发等. 视力筛查仪在低视力青少年屈光检查中的应用[J]. 中华眼科医学杂志,2011(1):49-53.
[24]吕健. 视力筛查仪在6岁以下儿童屈光常规保健和转诊标准研究[J]. 中国医疗器械信息,2016(22):67-68.
[25]Uchenna C.Atowa et,al. A review of paediatric vision screening protocols and guidelines[J].International Journal of Opthalmology, 2019(07):1194-1201.
[26] 李京蔓. 偏心摄影视力筛查仪的设计与研究[D/OL].吉林:长春理工大学,2019:74. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&dbname=CMFD202001&filename=1019924002.nh&uid=WEEvREcwSlJHSldRa1FhcEFLUmViSGY5UERzVlo3a0JlZFRNTVVvclpadz0=$9A4hF_YAuvQ5obgVAqNKPCYcEjKensW4IQMovwHtwkF4VYPoHbKxJw!!&v=MjcyMTVUcldNMUZyQ1VSN3FmWStkckZ5N2tVTHJNVkYyNkY3cTZHdEhNclpFYlBJUjhlWDFMdXhZUzdEaDFUM3E=.
[27] 刘红仙等. 视力筛查仪在儿童眼保健中的应用价值分析[J]. 中国斜视与小儿眼科杂志,2017,25(4):27-29.
[28] 陈妍. 视力筛查仪在儿童眼保健中的应用效果分析[J]. 中国医药指南,2019,17(30):198-199.
[29] 徐启程等. 运用双目视力筛查仪对5816例学龄前儿童屈光状态的筛查分析[J]. 现代适用医学,2020,32(01):62-63.
附件I 产品技术要求模板
附件II 编制说明
附件I 产品技术要求模板
医疗器械产品技术要求编号:
视力筛查仪
多型号时,应列表体现不同型号之间的差异。
软件名称、发布版本号、软件版本命名规则。
视力筛查仪应满足相应的光辐射安全标准的要求。(可参照ISO:15004-2)明确产品根据标准分类的类别及波源特点。
应符合表1的要求。
表1 数字显示筛查仪要求
|
项目内容 |
测量范围 |
最大宽度间隔 |
精度-两倍标准差 |
|
球镜和柱镜顶焦度 |
|
|
|
|
柱镜度的柱镜轴向a |
|
|
|
|
a柱镜轴向的表示应符合ISO 8329:1986的规定。 |
|||
筛查仪的顶焦度最小测量范围为:
带柱镜度显示的筛查仪的柱镜度最小测量范围为:
筛查仪的轴向测量范围为:
列出产品核心的软件功能,视实际情况决定是否适用。
明确数据接口、用户访问控制的要求
按照GB/T 14710-2009中气候环境II组和机械II组规定进行试验,经试验后,仪器应符合所有性能要求。
应符合GB 9706.1-2007标准要求,产品主要安全特征见附录A。
应符合YY0505-2012的要求。
略
附录A
医用电气设备安全通用要求
产品主要安全特征
附件II 编制说明
本指导原则来源于中心课题“主动健康数据采集产品的安全性和有效性评价规范研究”,课题编号:2018YFC2000801,隶属于科技部国家重点研发计划“主动健康和老龄化科技应对”重点专项项目“主动健康产品和人体健康态评估的安全有效体系及标准体系研究”,项目编号:2018YFC2000800。
根据课题制定的研究方向,确定本指导原则的研究产品为“视力筛查仪”。该产品与验光仪类似,但是核心光学原理、适用范围及使用方式均不同,且尚无指导原则。
经过广泛的调研后编写初稿,已征求部分相关国内外生产商及专家的意见,结合反馈意见,整理成征求意见稿。计划在广泛征求社会意见之后,充分讨论,进一步修改完善,形成定稿上报。

来源:中国器审


