您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2025-03-04 08:40
特异性皮炎(Atopic Dermatitis,AD)是一种慢性容易复发的皮肤炎性疾病,具有高患病率、高疾病负担的特点,给患者的生活质量带来了严重影响。近年来,随着对AD疾病机制研究的不断深入以及新型药物的研发,全球AD的治疗格局正在重塑,本文旨在梳理特异性皮炎的发病机理、在研药物、市场情况等,以期与读者共同学习并了解这一疾病领域现状。
一、流行病学研究
1、全球发病现状
流行病学数据显示,AD是全球非致命性疾病中疾病负担排名第15位的皮肤病,全球患者数超2.3亿,中重度患者占比约30%-40%[1]。其中儿童发病率为10%-20%,成人发病率为1%-3%。儿童期发病患者中,约50%的症状会持续至成年,且常伴随过敏性鼻炎、哮喘等并发症。成人AD患者中,心血管疾病、抑郁症和自身免疫性疾病共病风险显著增加[2]。
2、国内发病现状
在我国的AD患者约7000万,其中中重度患者超2000万,儿童患病率从1998年的3%上升至2023年的12%-15%[3]。我国婴幼儿期的患病率约为30.48%,1-7岁学龄前儿童为12.94%,成人约为10.6%。近年来,随着社会和生活习惯的改变,AD患病人数不断增加,至2020年已超过6700万人,预计到2025年将超过7500万人。特异性皮炎的发病主要与生活环境、生活方式、遗传因素和心里因素有关。城市化、空气污染(如PM2.5)、气候变化以及室内环境(如宠物毛发、尘螨)、高糖高脂饮食、过度清洁等均会造成AD病情加重[4-5]。
二、发病机制
AD的发病机制复杂,涉及皮肤屏障功能障碍、免疫失调、微生物组失衡、神经免疫相互作用 及遗传与环境因素的交互作用。
1、皮肤屏障功能障碍:主要诱因为丝聚蛋白(Filaggrin,FLG)基因突变。约30%-50%的AD患者存在FLG基因突变,导致角质层结构蛋白减少,皮肤屏障完整性受损。另一种诱因是皮肤角质层脂质代谢异常,神经酰胺合成减少,胆固醇和游离脂肪酸比例失衡,削弱了皮肤的保水能力。皮肤屏障被破坏,直接导致外界过敏原(如尘螨、花粉)和病原体(如金黄色葡萄球菌)更易穿透皮肤,触发免疫反应。
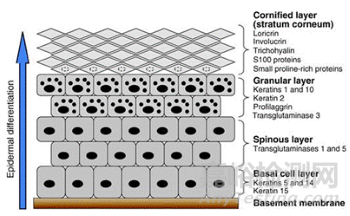
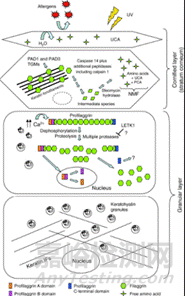
图1、Filaggrin代谢与皮肤屏障结构示意图[6]
2、免疫失调与Th2型炎症刺激:先天免疫异常可能引起炎性刺激,角质形成细胞释放胸腺基质淋巴细胞生成素(TSLP)、IL-25和IL-33,激活2型固有淋巴细胞(ILC2)和树突状细胞。而适应性免疫失衡将引起Th2主导、Th17/Th22参与的免疫反应,其中IL-4、IL-13、IL-31驱动瘙痒和炎症;IL-5促进嗜酸性粒细胞浸润;慢性期病变中IL-17和IL-22则会加重表皮增生和炎症。
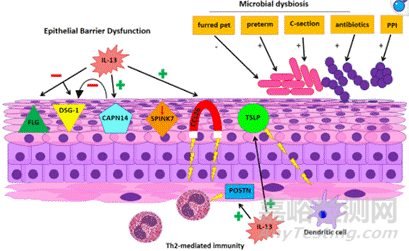
图2、AD免疫通路(Th2/Th17/Th22)与关键细胞因子网络[7]
3、微生物组失衡/金黄色葡萄球菌定植:AD患者皮肤表面常存在菌群失调的现象。皮肤表面金黄色葡萄球菌(S. aureus)过度增殖,分泌δ-毒素和蛋白酶,破坏屏障并激活TLR2/TLR4信号通路。S. aureus进一步通过生物膜形成和抗菌肽抵抗(如LL-37降解)逃避免疫清除。

图3、AD患者皮肤微生物组动态变化与炎症关系[8]
4、神经免疫相互作用与瘙痒机制:由Th2细胞分泌的IL-31,直接激活感觉神经元表面的IL-31受体(IL-31RA),诱发瘙痒,患者搔抓进一步破坏屏障,释放更多细胞因子(如TSLP),形成恶性循环;神经肽(如Substance P) 促进肥大细胞释放组胺和TNF-α,加剧炎症。

图4、IL-31/IL-13/IL-4信号通路与神经元激活机制[9]
5、遗传与环境触发因素:FLG、SPINK5(LEKTI蛋白酶抑制剂)、IL-4Rα等基因多态性增加AD风险;空气污染物(PM2.5)、硬水、过度清洁、压力等通过表观遗传修饰(如DNA甲基化)加剧炎症。
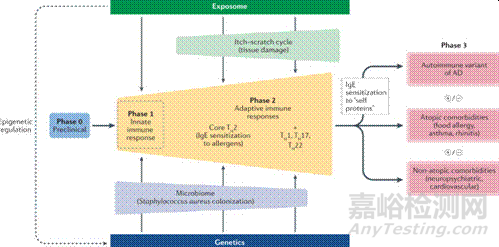
图5、AD遗传与环境交互作用示意图[10]
三、AD的治疗药物
(一)外用药物
特应性皮炎的化学药品治疗手段主要包括外用药物和系统用药。外用药物主要为糖皮质激素,也是AD的一线外用治疗手段,具有抗炎、抗过敏和免疫抑制的作用。根据强度不同,分为弱效、中效、强效和超强效。弱效糖皮质激素(如氢化可的松)适用于轻度皮损和面部、褶皱部位;中效(如曲安奈德)和强效(如卤米松)适用于中重度皮损。
另外,钙调磷酸酶抑制剂(TCI)如他克莫司软膏和吡美莫司乳膏是非激素类外用药物,适用于对糖皮质激素不耐受或需要长期维持治疗的患者,尤其适合用于面部和褶皱部位。
此外,PDE4抑制剂(如克立硼罗软膏)、TRPV1拮抗剂(PAC-14028乳膏)、AhR调节剂等,均能抑制下游炎性反应,改善并缓解AD症状,恢复皮肤屏障。
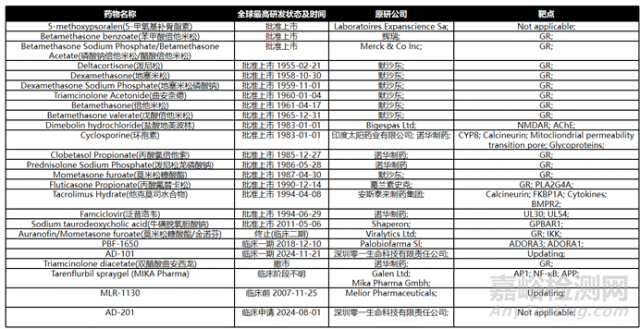
图6、针对AD适应症的化药药品(整理自药渡数据库)
(二)系统用药及辅助治疗
口服抗组胺药物(H1受体拮抗剂)对AD相关瘙痒和皮疹的改善效果有限,但可在一定程度上缓解夜间瘙痒。当AD患者出现金黄色葡萄球菌感染时,需使用抗生素进行局部或系统治疗。采取窄波UVB或UVA1光疗等辅助治疗手段,可用于中重度AD患者的辅助治疗。
(三)生物制剂
生物制剂是当前AD治疗领域的研究热点。靶向IL-4/IL-13通路抑制剂、靶向TSLP抑制剂、微生物组疗法、基因疗法、干细胞疗法等针对AD的新兴治疗手段百花齐放。
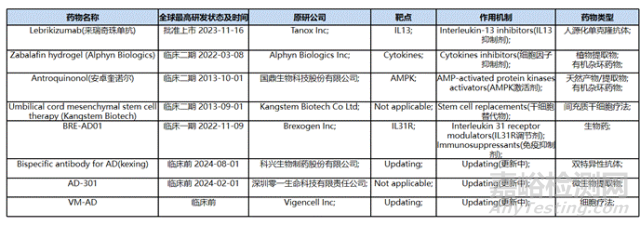
图7、针对AD适应症的生物药品(整理自药渡数据库)
1、自免类单克隆抗体:
1)赛诺菲/再生元的普利尤单抗(Dupilumab,IL-4Rα单抗),通过抑制白细胞介素-4(IL-4)和白细胞介素-13(IL-13)的信号通路,减少2型炎症反应,在特异性皮炎的治疗中表现出显著的临床效果。
u在一项长达5年的临床研究中,Dupilumab显示出持续的疗效,80%的患者湿疹症状得到良好控制,约2/3的患者用药频率逐渐降低至每3-4周一次。
u真实世界研究中,Dupilumab治疗中重度AD患者2年后,患者的湿疹面积和严重程度指数(EASI)、瘙痒评分(P-NRS)、生活质量指数(DLQI)等指标均显著改善,且安全性良好。
u对于6个月至5岁的中重度AD患儿,Dupilumab联合低效糖皮质激素治疗可在短期内显著缓解瘙痒和皮损,改善患儿及照料者的睡眠质量和生活质量。
u在6-11岁儿童中,Dupilumab治疗可在2周内显著改善AD体征和症状,并持续至16周,即使部分患者皮肤未完全清除,症状也显著改善。
u在12-18岁青少年中,Dupilumab治疗16周后,显著改善了AD的症状和生活质量,且安全性良好。
2)礼来的来瑞奇珠单抗(Lebrikizumab,IL-13单抗),能够特异性结合IL-13,阻止IL-13Rα1/IL-4Rα异二聚体复合物的形成,从而抑制IL-13的信号传导。在关键III期临床试验(Advocate 1和Advocate 2)中,接受Lebrikizumab治疗的患者在16周后皮肤症状消失或几乎消失的比例为38%,而安慰剂组仅为12%。此外,43%的患者在16周时瘙痒症状显著缓解。在维持治疗阶段,77%的患者在每月一次的维持剂量下,一年后仍保持皮肤症状的显著改善。与安慰剂相比,Lebrikizumab在治疗早期(如第4周)即可显著改善症状,部分患者在第2周即开始感受到瘙痒缓解。
3)在我国,康诺亚公司的司普奇拜单抗(IL-4Rα单抗)、康哲药业的CM310(IL-4Rα单抗)、康方生物的AK120(IL-4Rα单抗)、三生国健的SSGJ-613(IL-13单抗)等在不同的临床研究中均展示出各自的药物有效性,提示了我国在自身免疫疾病和特异性皮炎治疗领域取得了显著进展。
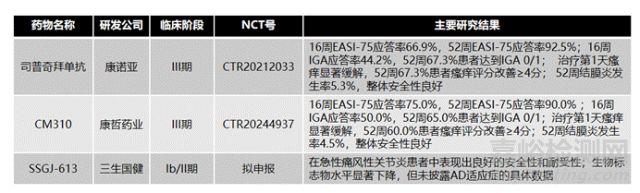
图8、国内治疗AD的单克隆抗体基本情况
4)新靶点TSLP抑制剂:Thymic Stromal Lymphopoietin(TSLP)是一种上皮细胞因子,位于炎症级联反应的顶端,在除OA外的多种炎性疾病(如哮喘、慢性鼻窦炎伴鼻息肉等)中发挥关键作用,能够触发多种炎症反应。通过高效阻断TSLP,Tezepelumab能够减少促炎细胞因子的释放,减轻炎症反应,改善患者的临床症状。目前针对AD的II期临床研究仍在进行中,更多数据尚未完全披露。
2、调节微生物组/细菌替代疗法:
1)FB-401(Forte Biosciences):结合三种罗氏菌属(Roseomonas mucosa)菌株,通过激活Toll样受体5(TLR5)和肿瘤坏死因子受体(TNFR)发挥抗炎和组织修复作用。在I/IIa期研究中,60%的成人患者SCORAD评分降低50%,90%的儿童患者达到EASI 50,30%达到EASI 90。
2)EDP1815(Evelo Biosciences):通过调节系统性炎症,改善AD症状。相关I期研究正在进行中。
3、干细胞治疗
间充质干细胞以其产品的免疫抑制与损伤修复这两大功能特性,也进入了AD这一赛道。
1)易文赛生物技术有限公司的脐带源间充质干细胞,在一项I/II期临床研究纳入34例中重度AD患者,皮下注射2.5×107或5.0×107 hUC-MSCs。结果显示高剂量组中55%的患者湿疹面积和严重程度指数(EASI)评分降低50%;瘙痒评分降低58%,且未见严重不良事件报告。
2)脂肪间充质干细胞(hAD-MSCs)在一项I/II期临床研究纳入50例65岁以上重度AD患者,静脉输注5.0×107 hAD-MSCs。结果显示患者湿疹面积显著改善,瘙痒缓解,且随访14个月未复发。
4、基于生物标志物的精准医疗及个性化治疗方案
随着对AD病理生理学的深入研究,生物标志物在疾病诊断、治疗靶点选择及疗效评估中的重要性日益凸显。精准医疗作为一种新兴的医疗模式,强调基于患者的个体特征(如基因信息、生物标志物等)制定个性化治疗方案,以提高治疗效果并减少不良反应。在AD治疗领域,精准医疗的应用逐渐成为研究热点,特别是针对特定细胞因子通路的靶向治疗策略,如IL-31Rα、OSMRβ和mIgE等生物标志物的靶向药物研发,为AD的个性化治疗提供了新的方向
1)IL-31Rα抑制剂(Nemolizumab)
Nemolizumab是一种针对IL-31受体α(IL-31Rα)的单克隆抗体。IL-31是一种由Th2细胞产生的细胞因子,与AD患者中的瘙痒症状密切相关。通过阻断IL-31与其受体的结合,Nemolizumab可以显著减轻瘙痒感,从而改善患者的生活质量。在一项III期研究中,Nemolizumab显示出显著改善瘙痒症状的效果,具体表现为患者瘙痒评分的显著降低,且这种改善在治疗过程中持续存在。研究还表明,Nemolizumab对瘙痒的改善效果独立于其他临床症状的改善,这意味着即使皮肤炎症没有完全消退,患者的瘙痒感得到了显著缓解。此外,Nemolizumab的安全性良好,未发现严重的不良反应,使其成为一种有潜力的AD治疗选择。
2)OSMRβ抑制剂(Vixarelimab)
Vixarelimab是一种针对Oncostatin M受体β(OSMRβ)的单克隆抗体。IL-31信号通路涉及IL-31与其受体复合物(包括IL-31Rα和OSMRβ)的结合,从而引发下游的信号传导,导致瘙痒和炎症反应。Vixarelimab通过阻断OSMRβ,抑制IL-31信号通路的激活,从而减轻瘙痒症状。已被美国FDA授予突破性疗法认定,用于治疗与结节性痒疹相关的瘙痒。这表明其在缓解瘙痒症状方面具有显著的潜力。此外,Vixarelimab的安全性良好,未发现用药相关的严重不良反应,有望成为多种炎症性疾病的治选择。
3)mIgE靶向治疗(FB825/anti-CεmX)
FB825是一种针对膜IgE(mIgE)的单克隆抗体。IgE在AD的发病机制中起着关键作用,尤其是在过敏反应和瘙痒信号传导中。通过靶向mIgE,FB825可以减少IgE介导的过敏反应,从而减轻AD症状。目前,FB825正在进行IIa期研究,旨在评估其在AD患者中的安全性和有效性。初步研究结果显示,FB825在降低IgE水平和改善AD症状方面具有潜力,尤其是在减少瘙痒和炎症方面。该研究还在评估FB825对不同亚型AD患者的疗效,以确定其在个体化治疗中的应用潜力。
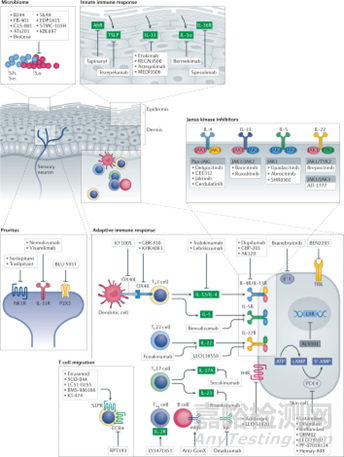
图9、特异性皮炎的在研治疗药物[10]
四、研发挑战与解决策略
在AD的治疗中,中重度患者仍面临诸多未满足的需求。目前的治疗手段仍存在诸多局限性,尤其是在长期治疗的安全性和有效性方面。
1、传统治疗手段仍有局限性,糖皮质激素是治疗中重度AD的传统选择,但长期使用可能导致一系列副作用,包括皮肤萎缩、色素沉着、向心性肥胖、骨质疏松、血糖升高、感染风险增加等。此外,糖皮质激素的长期使用还会导致耐受,疗效逐渐降低。而口服免疫抑制剂(如环孢素、甲氨蝶呤等),虽然在控制炎症方面有一定效果,但其副作用较为严重。长期使用可能导致肝肾功能损伤、骨髓抑制(如白细胞减少、贫血)、胃肠道反应(如恶心、呕吐)、感染风险增加,甚至可能增加患癌风险。
2、生物制剂的局限性
生物制剂(如IL-4/IL-13单抗等)疗效虽好,但其价格较高,容易造成患者经济负担;而且抗体药物给药周期较长,需要定期注射,增加了患者的治疗负担病影响患者顺应性。
针对(1-2)的局限,我们的治疗策略正在从传统的Th2通路逐步扩展至神经免疫(IL-31)、上皮屏障(IL-33)以及OX40等新兴机制。多元化靶点的开发旨在更加全面的覆盖复杂病理机制,为不同亚型的AD患者提供更精准的治疗选择。
3、未被满足的治疗需求,不同患者的病情严重程度、病因和对药物的耐受性存在差异,因此需要更加精准的个体化治疗方案。解决策略:JAK抑制剂的研发正朝着更高选择性的方向发展,例如JAK1特异性抑制剂的出现显著降低了对其他JAK亚型的非特异性抑制,从而减少了不良反应。此外,外用制剂的开发也在逐渐减少全身暴露,进一步提升药物的安全性。以生物标志物(如IgE水平、TARC)为基础的个性化治疗应用正逐渐成为指导用药的重要工具。通过精准匹配患者亚型,个体化治疗方案能够提高治疗效果,同时减少不必要的药物暴露。
4、未来重点开发方向:可考虑联合用药策略,通过生物制剂与外用药物、免疫调节剂或光疗的联合使用,以期增强疗效并减少单一药物的剂量,降低副作用。开发长效缓释制剂等新型药品,以满足患者的长期治疗需求。
五、总体市场机遇
我国特异性皮炎患者人数庞大且逐年增加,预计到2025年将超过7500万人,为药物市场提供持续需求。预计到2025年,中国特应性皮炎药物市场规模有望突破百亿元,未来市场空间广阔。随着医保水平提升,医保覆盖程度扩大,更多创新药物纳入医保,患者可及性增加。国内药企研究进展迅速,有望通过本土化的价格优势和医保覆盖,加速进口替代。
六、小结:
综上所述,特异性皮炎作为一种高患病率、高疾病负担的慢性皮肤病,市场需求巨大。随着不同靶点的生物制剂、免疫调节剂等新型药物的研发和上市,AD治疗将进入新的阶段。未来,随着更多创新药物的获批,AD药物市场有望持续扩容,为患者提供更多的治疗选择。我国的AD药物行业正处于创新转型期,国内企业正在加速布局,并在不断平衡疗效、安全性与可及性。相信不久的将来,IL-4Ra、IL-31等靶向药、细胞疗法、基因治疗或将成市场核心驱动力,为更多保守特异性皮炎困扰的患者带来福祉。
参考资料:
1、Institute for Health Metrics and Evaluation (IHME).Global Burden of Disease Collaborative Network. (2020).
2、Weidinger S, Novak N.Atopic Dermatitis: Natural History, Diagnosis, and Treatment.The Lancet,2021.
3、李萍、严星强、张珍珍,儿童特应性皮炎的流行病学研究现状。
4、Guo Y, Li P, Tang J, et al.Atopic Dermatitis in China: Prevalence and Risk Factors.2016
5、北京大学医学部, 中国大陆7岁以上人群特应性皮炎流行病学调查。2018年。
6、Sandilands, A., et al. (2007).Filaggrin in the frontline: role in skin barrier function and disease.Journal of Cell Science, 122(9), 1285-1292.
7、Lyles J, Rothenberg M. Role of genetics, environment, and their interactions in the pathogenesis of eosinophilic esophagitis. Curr Opin Immunol. 2019 Oct;60:46-53.
8、Gomez-Casado, C., Unger, Z., Olah, P. et al. Microbiome in Atopic Dermatitis: Is It All About Staphylococcus aureus?. Curr Treat Options Allergy 10, 351–363 (2023).
9、Oetjen, L. K., et al. (2017).Sensory neurons co-opt classical immune signaling pathways to mediate chronic itch.Cell, 171(1), 217-228.
10、Bieber, T. (2020).Atopic dermatitis: an expanding therapeutic pipeline for a complex disease.Nature Reviews Drug Discovery, 19(1), 1-21.

来源:药事纵横


