您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-11 09:28
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.科兴生物23价肺炎疫苗在中国获批上市。科兴生物研制的23价肺炎球菌多糖疫苗获国家药监局批准上市,用于预防由23种血清型肺炎球菌引起的感染性疾病。该疫苗是科兴生物获批上市的第一个细菌类疫苗产品,它采用23种广泛流行、具侵袭性的血清型肺炎球菌,包括血清型1、2、3、4、5、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17F、18C、19A、19F、20、22F、23F和33F,是目前已上市产品中防护面最广的肺炎球菌疫苗之一。
2.健康元吸入用布地奈德混悬液获批上市。健康元4类仿制药吸入用布地奈德混悬液收到国家药监局核发的《药品注册证书》。布地奈德混悬液属吸入性糖皮质激素,原研是阿斯利康的普米克令舒,2001年获批进口中国,用于支气管哮喘的治疗。根据IQVIA抽样统计估测数据,国内布地奈德吸入混悬液2019年度终端销售金额约为人民币56.32亿元。该品种目前仅有正大天晴和健康元两家国内药企获批上市。
3.开拓药业ALK-1抗体联合PD-1临床结果积极。开拓药业将在ASCO GI2021年会上公布其ALK-1/TGF-β靶向抗体GT90001联合用药的Ⅱ期临床积极数据。该研究评估GT90001联合PD-1抗体nivolumab对一线索拉非尼或仑伐替尼治疗后进展的晚期肝细胞癌(HCC)患者的安全性和有效性。结果显示,在20例可评估患者中,有8例(40%)患者观察到部分缓解(PR),且安全性良好。GT90001和nivolumab的药代动力学参数与单药治疗相似。
4.百奥泰司库奇尤单抗生物类似药申报临床。百奥泰司库奇尤单抗注射液的临床试验申请获CDE受理。司库奇尤单抗是一款靶向IL-17A的生物制剂,原研产品为诺华的可善挺(Cosentyx),已在中国获批用于中重度斑块型银屑病(PsO)和强直性脊柱炎(AS)。目前尚未有其他公司在中国递交司库奇尤单抗生物类似药临床试验申请,百奥泰生物为首家。
5.恒瑞干眼病新药NOV03(全氟己基辛烷)获批临床。恒瑞医药SHR8058滴眼液获国家药监局一项临床试验默示许可,拟开发用于治疗睑板腺功能障碍相关干眼病。SHR8058滴眼液是恒瑞从德国Novaliq GmbH公司引进的NOV03(全氟己基辛烷)。SHR8058滴眼液通过在眼表面形成稳定包膜、防止泪液过强蒸发,治疗与睑板腺功能障碍相关蒸发过强型干眼症。除德国Novaliq公司的NovaTears在欧盟和澳大利亚已作为医疗器械上市外,目前无同机制产品上市。
国际药讯
1.礼来GIP/GLP-1双重激动剂Ⅲ期临床结果积极。礼来GIP/GLP-1受体双重激动剂tirzepatide治疗2型糖尿病的Ⅲ期临床SURPASS-1获得积极顶线结果。在治疗40周后,与安慰剂组相比,tirzepatide显著降低成人患者的糖化血红蛋白(A1C)水平和体重。其中最高剂量(15 mg)的tirzepatide将患者A1C水平降低2.07%,降低体重9.5公斤(11.0%)。该组中51.7%的患者A1C水平低于5.7%,这是未患糖尿病人群中观察到的水平。礼来预计在2022年在全球递交监管申请。
2.艾伯维JAK抑制剂达Ⅲ期临床终点。艾伯维JAK抑制剂upadacitinib治疗中重度溃疡性结肠炎的Ⅲ期临床达主要终点和所有关键次要终点。upadacitinib治疗组第8周时有26%的患者达到临床缓解,安慰剂组这一数值为5%(p<0.001);两组达到内镜检查改善的患者比例分别为36%和7%(p<0.001),达到临床应答的患者比例分别为73% vs 27%(p<0.001)。Upadacitinib此前已获FDA批准用于治疗中重度活动性类风湿关节炎,目前正在多项临床中评估用于治疗特应性皮炎等多种炎症性疾病。
3.强生Darzalex皮下注射治疗骨髓瘤Ⅲ期临床成功。强生在ASH2020年会上公布了Darzalex治疗骨髓瘤的Ⅲ期临床Apollo积极数据。与Pomalyst和地塞米松联用相比,Darzalex Faspro与Pomalyst和类固醇地塞米松联用,可以减缓骨髓瘤疾病进展,将患者死亡风险降低37%。两组的中位生存时间分别为12.4个月和6.9个月。此外,Darzalex联合治疗使得Revlimid治疗无效患者的疾病进展时间延长(9.9个月vs6.5个月),与二联用药相比,Darzalex治疗组患者的完全应答率高出6倍以上(25%vs4%),而最小残留疾病阴性率高出4倍(9%vs2%)。
4.INOVIO新冠疫苗INO-4800启动Ⅱ期临床。INOVIO公司新冠候选疫苗INO-4800在Ⅱ期临床中完成了首位受试者给药。这是一项Ⅱ/Ⅲ期临床INNOVATE研究的一部分。INOVIO计划在美国招募约400名年龄18岁或以上的参与者,评价INO-4800在2剂量方案(1.0 mg或2.0 mg)中的安全性、耐受性和免疫原性。INNOVATE试验由美国国防部化学生物放射和核防御联合计划执行办公室出资,与国防部卫生事务助理部长办公室和国防卫生局协作完成。
5.辉瑞肺炎球菌疫苗获FDA优先审评资格。FDA受理辉瑞20价肺炎球菌偶联疫苗20vPnC的生物制品许可申请,用于18岁以上成人预防由肺炎链球菌引起的侵袭性疾病和肺炎。FDA同时授予其优先审评资格,预计明年6月之前做出回复。20vPnC疫苗包括已上市的Prevnar 13中含有的13种血清型,与另外7种新血清型。新增的7种血清型与侵袭性肺炎球菌疾病,高病死率,抗生素耐药性和/或脑膜炎的发生相关。
6.诺和诺德联手Procyon开发糖尿病创新疗法。诺和诺德与Procyon Technologies达成一项独家合作及许可协议,将利用Procyon公司氧植入式细胞封装设备开发技术,结合诺和诺德干细胞衍生胰岛素分泌细胞方面的专业知识,共同开发用于1型糖尿病的功能性治愈创新疗法。根据协议,Procyon Technologies将获得一笔预付款,与临床前、临床和监管里程碑付款,以及产品的销售分成。诺和诺德将负责1型糖尿病合作产品的开发、制造和商业化。
医药热点
1.英国两医护接种辉瑞新冠疫苗后出现过敏症状。当地时间8日,英国正式启动辉瑞新冠疫苗接种工作。据英媒报道,有两名英国卫生工作者在接种后出现了过敏症状。鉴于此,英国药品监管机构建议,有严重过敏史的人不要接种辉瑞/BioNTech的新冠疫苗。目前英国药品监管机构正积极调查相关原因。辉瑞此前曾表示,并没有对疫苗或疫苗成分有严重不良过敏反应史的人参与过后期试验。
2.北京积水潭医院“骨科手术机器人”成果转化。12月9日,在北京积水潭医院第二届医工结合科技创新大赛暨2020年科技成果推介会上,北京积水潭医院与北京天智航医疗公司签订了“骨科手术机器人”成果转化协议。协议包括专利转让、建立智慧骨科研究基金及共建联合实验室,总转化额达到1.023亿元。据悉,积水潭医院是北京市科技部首批职务科技成果赋权改革试点单位,“骨科手术机器人”由该院田伟院士研发团队主导研发。
3.浙江启动新一轮基层机构绩效考核。近日,浙江省卫健委印发《关于加强基层医疗卫生机构绩效考核的实施意见(试行)》,启动新一轮基层医疗卫生机构绩效考核。据悉,浙江省为加快推进绩效考核的组织实施,包括建设开发绩效考核信息化支撑平台、制定绩效考核操作手册、开展绩效考核培训等,计划2021年上半年依托省级信息平台采集来源于现有系统的17个指标数据开展省级监测评价工作,客观反映基层机构的综合实力和薄弱环节,切实引导基层医疗卫生机构可持续发展。
股市资讯
【欧普康视】公司在研产品“角膜塑形用硬性透气接触镜”通过伦理会审查,且完成备案,可开展临床试验。
【健康元】公司“吸入用布地奈德混悬液”收到药监局签发的《药品注册证书》。
【灵康药业】子公司灵康制药“注册用奥美拉唑钠”通过一致性评价。
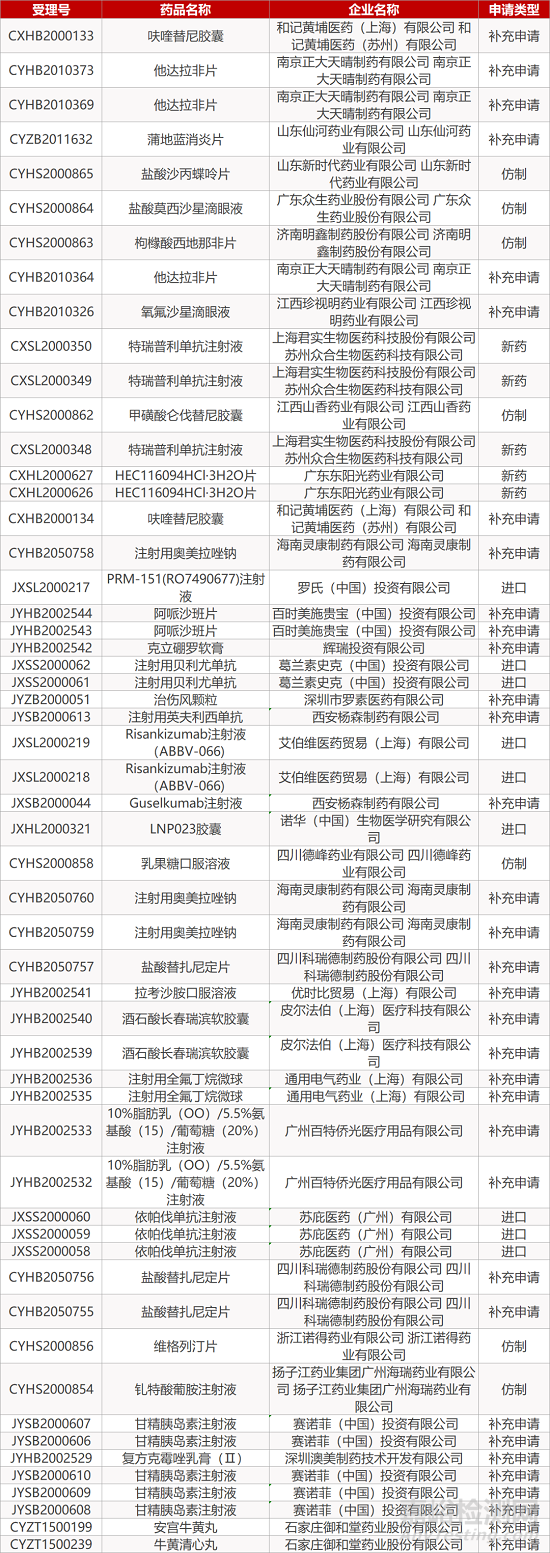
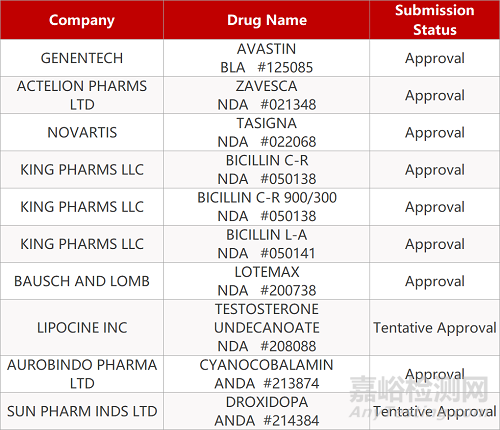
审评动向
- The End -

来源:药研发


