您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-01-26 17:36
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
GSK终止LAG-3单抗溃疡性肠炎II期研究。葛兰素史克(GSK)与Immutep公司的合作品种LAG-3单抗GSK2831781(IMP731)终止了针对活动性溃疡性肠炎的II期临床项目。GSK是在完成预定的期中分析并与数据评估委员会讨论后做出此决定,目前仍在开展进一步的疗效、安全性和生物学机制评估,以确定该药物的下一步临床开发计划。除了溃疡性肠炎之外,GSK也在开发GSK2831781的银屑病适应症,目前处于I期阶段。
国内药讯
1.奥赛康注射用奈达铂首家通过一致性评价。奥赛康注射用奈达铂以补充申请形式获批通过一致性评价,为国内首家。奈达铂为顺铂类似物,适用于头颈部癌、小细胞癌、非小细胞肺癌、食管癌、卵巢癌等实体瘤,其2019年中国公立医疗机构终端销售额超过7亿元。目前国内共有4家企业拥有该品种生产批文。除奥赛康外,还有齐鲁、南京先声东元制药也提交了一致性评价补充申请,目前仍旧处于“审评审批中”。
2.扬子江碘海醇注射液通过一致性评价。扬子江碘海醇注射液以补充申请获批通过一致性评价,为该品种继司太立之后第二家通过一致性评价。碘海醇注射液是一种含有三个碘原子的非离子水溶性造影剂,主要用于心血管造影、冠状动脉造影、尿路造影等。目前国内有12家企业拥有该品种生产批文,其中扬子江药业市场份额占比最大,超过50%。据米内网数据,2019年中国公立医疗机构终端该品种销售额超过35亿元。
3.艾伯维JAK1抑制剂拟纳入优先审评。艾伯维乌帕替尼缓释片(upadacitinib)两项上市申请获CDE拟纳入优先审评,拟开发适应症为:用于适合系统性治疗的成人和12岁及12岁以上青少年中重度特应性皮炎患者。两项上市申请分别对应30mg和15mg两种规格。upadacitinib是一款JAK1抑制剂,已获FDA批准上市,用于治疗对甲氨蝶呤反应不足或不耐受的中重度活动性类风湿关节炎成人患者。此外该新药用于中重度特应性皮炎的新适应症正在接受FDA的审查。
4.德琪SINE抑制剂ATG-010获临床试验默示许可。德琪医药与Karyopharm 公司的合作品种ATG-010(selinexor,XPOVIO®)联合R-GDP用于治疗复发难治性弥漫性大B细胞淋巴瘤(rrDLBCL)的临床试验申请获CDE批准。这是一项国际Ⅱ/Ⅲ期研究,旨在评价这一联合疗法的疗效及安全性。XPOVIO®是同类首款口服型SINE抑制剂,已获FDA批准联合低剂量地塞米松用于治疗复发难治性多发性骨髓瘤(rrMM)患者;以及单药口服疗法用于治疗rrDLBCL患者。
5.拜耳“不限癌种”抗癌新药在华获批临床。拜耳1类新药selitrectinib口服混悬液用粉末获CDE临床试验默示许可,拟开发用于NTRK融合的成人和儿童肿瘤。该新药是Loxo Oncology(已被礼来收购)开发的新一代TRK抑制剂,已在治疗携带NTRK基因融合的实体瘤患者方面显示出优异的疗效,并且它还能够治疗对口服TRK抑制剂Vitrakvi产生抗性的实体瘤患者。目前拜耳拥有这款“不限癌种”候选药物的独家研发权益。
6.爱科百发生物科技公司完成C轮融资。爱科百发宣布完成C轮融资。本轮融资由高瓴创投、TPG、燕创资本、德诚资本联合领投,华兴资本担任本轮交易的独家财务顾问。爱科百发专注于抗病毒、呼吸疾病、纤维化疾病和儿科等疾病领域,目前已建立了10余款创新药物管线。其中,Ziresovir(AK0529)是全球首个进入Ⅲ期临床的抗呼吸道合胞病毒(RSV)创新药,已获CDE纳入突破性治疗品种。
国际药讯
1.CD123靶向药ELZONRIS获欧盟批准上市。欧盟委员会(EC)批准Menarini Group公司CD123靶向药物ELZONRIS(tagraxofusp)上市,用于单药一线治疗成人母细胞性浆细胞样树突细胞肿瘤(BPDCN)患者。ELZONRIS也是欧洲批准针对这类患者的首款治疗药物。该新药已于2018年获FDA批准上市,目前已获批用于成人和两岁或以上儿科BPDCN患者的治疗。BPDCN是一种预后不良的侵袭性恶性血液病。
2.ICV注射液日本获批治疗亨特综合征。Green Cross Corporation与Clinigen K.K.合作开发的酶替代疗法Hunterase侧脑室内(ICV)注射液15mg(idursulfase-beta)获日本厚生劳动省批准上市,用于治疗粘多糖病II型(亨特综合征)。这是一种遗传性溶酶体病,溶酶体先天性缺乏导致神经、骨骼、关节和器官出现各种症状,其中约70%的患者患有中枢神经系统症状。据悉,这是Hunterase ICV注射液的全球首批,该疗法也是全球唯一一款获批针对粘多糖病II型病中枢神经系统症状的治疗药物。
3.诺和诺德司美鲁肽新规格申报美国上市。诺和诺德宣布其GLP-1受体激动剂司美鲁肽(semaglutide)皮下制剂已向FDA递交了2.0mg规格的补充上市申请,每周皮下注射1次,用于治疗2型糖尿病。目前,司美鲁肽在美国获批的是0.5 mg和1.0 mg规格。在SUSTAIN FORTE研究中,与司美鲁肽1.0mg剂量组相比,司美鲁肽2.0mg剂量显著改善了需要强化治疗的2型糖尿病患者的血糖水平,而且安全性、耐受性良好。值得一提的是,索马鲁肽2.4mg用于肥胖症的上市申请目前正接受FDA的优先审查。
4.LumiraDx新冠病毒抗原检测试剂在日本、巴西获批。LumiraDx公司开发的新冠病毒(SARS-CoV-2)抗原检测试剂已获巴西卫生监管机构和日本厚生劳动省批准上市。据悉,这款由微流体免疫荧光检测技术开发的SARS-CoV-2抗原检测试剂,目前已在美国、欧洲、中东、非洲和亚太地区实现商业化,适用于在社区医疗机构中为患者检测鼻或鼻咽拭子标本中的SARS-CoV-2抗原,仅需12分钟便可获得高灵敏度检测结果。
5.BMS多发性硬化药物Zeposia遭NICE拒绝。百时美施贵宝(BMS)公司多发性硬化药物Zeposia(ozanimod)遭英国国家健康与护理卓越研究所(NICE)拒绝。NICE认为该药成本效益的估算结果不在英国国家医疗服务体系(NHS)可以接受的资源使用范围之内。Zeposia是一款口服S1P调节剂,已在美国和欧盟获批上市,用于治疗成人复发型多发性硬化(RMS),包括临床孤立综合征、复发缓解型疾病和活动性继发进展型疾病。
医药热点
1.连花清瘟抗新冠肺炎药理活性成分研究进展。厦门大学药学院吴彩胜教授联合海军军医大学柴逸峰教授团队在连花清瘟胶囊防治新冠肺炎的药理活性成分和机制研究方面取得新进展,研究成果《基于人体暴露和ACE2生物色谱筛选传统中药连花清瘟胶囊的抗COVID -19药理活性成分》发表于《药学学报》上。这是连花清瘟胶囊在人体体内成分研究的首次阐述,为其在抗新冠肺炎(COVID-19)的药理活性成分和作用机制研究提供了化学和药理学理论依据。
2.和黄医药索凡替尼慈善援助项目启动。和黄医药自主研发的创新肿瘤药苏泰达(索凡替尼胶囊)上市会在北京、上海和广州三地举行。索凡替尼是一种新型的口服酪氨酸激酶抑制剂,已获NMPA批准用于治疗非胰腺神经内分泌瘤。中国初级卫生保健基金会在本次大会正式启动“苏达新生患者援助项目”,和黄医药将无偿提供索凡替尼,并由中国初级卫生保健基金会独立负责项目管理、监督、审核和实施。
3.22%的居民使用过互联网医疗。由上海交通大学健康长三角研究院与健康报移动健康研究院联合撰写的《互联网医疗的现实与未来》报告日前发布。报告显示,新冠肺炎疫情后,仅有22.07%的居民使用过互联网医疗,与2015年类似调查的22.1%几乎相同。虽然调查显示互联网医疗发展并未迎来突破,但疫情发生后,我国的互联网医院建设速度明显加快,有超过七成医生反馈所在医院已经或正在推进互联网医院的建设。
股市资讯
【海思科】全资子公司四川海思科制药有限公司申报的HSK29116散剂的药品临床试验申请获得国家药监局受理。
【康泰医学】公司的动态生命体征参数监测仪近日取得了由河北省药监局颁发的1项《医疗器械注册证》,该监测仪适用于动态心电图、动态血压、血氧饱和度及脉率的无创监测。
【康龙化成】预计2020年营业收入50.35-52.22亿元,同比增长34%-39%;归母净利润11.33-11.87亿元,同比增长107%-117%;扣非归母净利润7.78-8.28亿元,同比增长54%-64%;经调整的非《国际财务报告准则》下归母净利润10.32-10.87亿元,同比增长88%-98%。
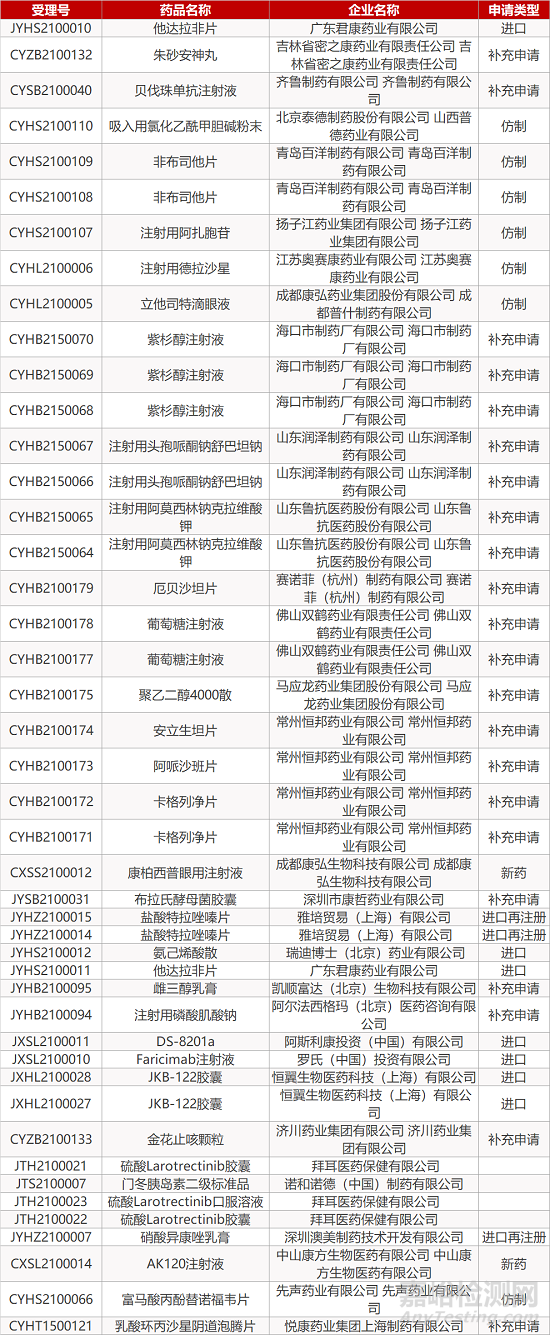
审评动向
- The End -

来源:药研发


