您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-04-19 08:28
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
先导STING非核苷酸类激动剂获批临床。成都先导1类新药注射用HG381获国家药监局临床试验默认许可,拟用于晚期实体瘤的治疗。HG381是一款STING非核苷酸类激动剂,已在临床前的结肠癌、肝癌、乳腺癌、肺癌等多个小鼠肿瘤模型中都表现出显著疗效,而且能够诱导机体产生肿瘤免疫记忆,抑制肿瘤再生。具有单药或者与免疫检查点抑制剂联合用药的治疗前景。HG381是成都先导第3个获得临床许可的新药项目,也是国内首个获批临床的STING激动剂。
国内药讯
1.两款中国新冠疫苗针对501Y.V2突变株中和效力数据发表。中国疾控中心高福等在《柳叶刀-微生物》上最新发表了国药中生北京公司灭活疫苗BBIBP-CorV和智飞龙科马重组亚单位疫苗ZF2001针对南非发现的501Y.V2突变株的中和活性研究数据。与野生型或D614G病毒株相比,两种疫苗接种者血清针对501Y.V2产生的平均滴度(GMT)稍有降低,其中BBIBP-CorV接种者血清的GMT从110.9(95%CI 76.7–160.2)降至71.5(95%CI 51.1–100.1);而ZF2001接种者血清的GMT从106.1(95%CI 75.0–150.1)降至66.6(95%CI 51.0–86.9)。数据显示两款国产疫苗针对南非新变种依然有保护效果。
2.科兴新冠疫苗在智利的保护效力达67%。智利卫生部公布第一份由中国科兴公司研制的克尔来福新冠疫苗有效率研究报告。报告显示,在接种两剂疫苗14天后,对预防新冠肺炎感染的有效率达到67%,住院病例预防率为85%,重症病例预防率为89%,感染死亡预防率为80%。未来智利卫生部将会每月更新中国科兴疫苗的有效率数据。
3.渤健富马酸二甲酯在华获批上市。渤健富马酸二甲酯肠溶胶囊 (dimethyl fumarate)获国家药监局批准上市。用于包括临床孤立综合征、复发缓解型、活动性继发进展型复发型多发性硬化成年患者的治疗。富马酸二甲酯是渤健的重磅产品,最早于2013年3月获得FDA批准上市,商品名为Tecfidera,是继芬戈莫德、特立氟胺之后全球上市的第3款口服多发性硬化症药物。去年10月,CDE已把该药纳入第三批临床急需境外新药名单。
4.甘莱THR-β激动剂ASC41美国临床新进展。歌礼旗下甘莱制药ASC41口服片剂在美国开展的I期临床中完成首个队列给药。ASC41是一种肝脏靶向性前体药物,其活性代谢产物可选择性激活甲状腺激素受体ß(THR-ß)。该项临床研究由两个队列组成:队列一是一项药物相互作用(DDI)研究,以评估伊曲康唑和苯妥英对ASC41在健康志愿者中的药代动力学影响;队列二是一项评估ASC41在非酒精性脂肪性肝病患者中的药代动力学、安全性和耐受性研究。
5.恒瑞BTK抑制剂联合用药临床试验获批。恒瑞1类新药BTK抑制剂SHR1459片获国家药监局临床试验默示许可,拟联合YY-20394开展用于治疗复发/难治B细胞非霍奇金淋巴瘤的临床研究。YY-20394(linperlisib)是璎黎药业开发的一种口服PI3Kδ抑制剂,目前正在全球进行临床开发,其用于治疗滤泡淋巴瘤和慢性淋巴细胞白血病已获FDA授予孤儿药资格。今年2月,恒瑞已与璎黎药业达成合作,获得YY-20394在大中华地区的联合开发权益以及排他性独家商业化权益。
6.阿诺医药公布新型hTNFR2抗体临床前研究数据。阿诺医药在AACR2021年会上公布了免疫刺激性anti-hTNFR2抗体AN3025的临床前数据。结果显示,AN3025在结合人体TNFR2方面显示出极高的亲和力,并可阻断TNFR2与TNF的相互作用。该抗体在Treg/Teff共培养试验中对干扰素-γ(IFN-γ)的产生表现出一定的促进作用,并在hTNFR2小鼠模型单独给药试验中显著抑制了MC38肿瘤的生长。
国际药讯
1.BMS的PD-1组合疗法一线治疗胃癌获FDA批准。FDA批准百时美施贵宝(BMS)PD-1抑制剂Opdivo(nivolumab)联合化疗,用于一线治疗晚期或转移性胃癌、胃食管结合部(GEJ)癌和食管腺癌。这也是FDA批准的首款一线治疗胃癌的免疫疗法。在一项Ⅲ期临床CheckMate-649中,与化疗组相比,这一组合疗法显著提高患者的总生存期(OS),两组中位OS分别为13.8个月和11.6个月;在肿瘤表达PD-L1(CPS>5)的患者中,两组中位OS分别为14.4个月和11.1个月;组合疗法将死亡风险降低29%(HR=0.71,98.4% CI,0.59-0.86,p<0.0001)。
2.FDA撤销礼来新冠中和抗体bamlanivimab紧急使用授权。FDA宣布取消礼来开发的新冠中和抗体药物bamlanivimab(LY-CoV555)单独使用治疗COVID-19的紧急授权(EUA)。FDA取消LY-CoV555的原因在于该抗体对美国目前流行的B.1.1.7等突变株治疗效果不理想,从而导致治疗失败。但是礼来含有LY-CoV555的抗体组合bamlanivimab +etesevimab的EUA依然有效。截止到3月中旬,美国预计约有20%的突变株对bamlanivimab产生抗药性。
3.TG新一代CD20抗体治疗MS达两项Ⅲ期主要终点。TG Therapeutics创新糖工程化抗CD20抗体ublituximab治疗复发型多发性硬化(MS)的两项Ⅲ期临床(ULTIMATE I和ULTIMATE II)获积极结果。与teriflunomide相比,ublituximab治疗组96周时将患者的疾病年复发率降低到0.10以下,年复发率分别降低了60%和49%;此外,在降低患者大脑病灶数目,延缓残疾进展等方面也提供显著益处。该公司计划在今年第三季度向FDA递交其上市申请。
4.罗氏公布重磅Ocrevus治疗早期MS最新临床结果。罗氏CD20抗体Ocrevus(ocrelizumab)治疗早期多发性硬化(MS)的Ⅲb期临床ENSEMBLE获积极结果。中期分析显示,有85%的初治患者在Ocrevus治疗48周后未出现任何疾病进展(包括无疾病复发、无残疾加重,MRI成像显示无新增或扩展大脑病灶),疾病年复发率仅为0.005;而且生物标志物NfL水平由基线水平10.5 pg/mL降低至4.55 pg/mL,与健康对照组4.12 pg/mL数值相似。
5.默沙东停止开发新冠候选药物MK-7110。默沙东日前宣布取消MK-7710的开发。MK-7710是该公司收购OncoImmune获得的一款正在Ⅲ期评估治疗COVID-19住院患者的候选药物CD24Fc。2020年7月,CD24Fc已获得Ⅲ期临床中期疗效分析阳性顶线数据。但FDA希望得到更多新的临床研究数据。鉴于时间安排,以及技术、临床和监管方面的不确定性,默沙东决定停止MK-7710的研制,并将重点推进另一款口服抗新冠病毒候选药物molnupiravir(MK-4482)。
6.勃林格殷格翰和MD安德森扩大研发合作。勃林格殷格翰(BI)和德克萨斯大学MD安德森癌症中心宣布延长和扩大其联合虚拟研发中心(VRDC),以探索BI的KRAS(Kirsten大鼠肉瘤)和TRAILR2(TNF相关的凋亡诱导因子配体受体2)组合中的新分子,用于开发针对肺癌尤其是非小细胞肺癌的潜在疗法。勃林格殷格翰目前正针对KRAS突变进行全面的研究,预计该公司同类首创泛KRAS抑制剂(BI 1701963),KRAS G12C抑制剂(BI 1823911)和MEK(BI 3011441)等多个新药将加入这项联合用药临床研究。
7.赛默飞世尔拟收购CRO服务商。赛默飞世尔公司宣布将以高达174亿美元的现金价格,收购全球知名的临床研究服务CRO提供商PPD。PPD成立于1985年,总部位于美国威尔明顿,在世界范围内近50个国家设有办事机构,拥有26000多名专业雇员。PPD去年的收入达到了47亿美元。赛默飞世尔董事长兼总裁兼首席执行官Marc N. Casper表示,收购PPD,是赛默飞世尔业务的自然延伸。该公司今年以来在收购方面花费的金额接近190亿美元。
医药热点
1.湖北全面优化医学人才培养。湖北省印发《加快全省医学教育创新发展实施方案》。《方案》提出,提升医学专业学历教育层次,严格控制高职(专科)临床医学类专业招生规模,逐步形成以护理专业为主体的医学高等职业教育体系;支持部属高校适度扩大医学博士招生规模,支持省属高校适度扩大医学硕士招生规模;从2021年开始,停止中职层次农村医学、中医专业招生。
2.北京妇产医院新建母胎医学科。北京妇产医院母胎医学科4月16日正式揭牌成立。母胎医学是关乎母体和胎儿的双重学科,重点收治单绒双羊双胎、复杂性双绒双羊双胎、多胎妊娠、胎儿水肿综合征、胎儿溶血性疾病、胎儿贫血及各种胎儿结构异常等疾病患者;与儿外科联合开展胎儿镜下后尿道瓣膜切开、主动脉球囊扩张及孕期的开放性胎儿手术、胎儿镜下气管球囊封堵术等宫内手术。该学科旨在降低高危孕产妇妊娠并发症及胎儿出生缺陷发病率,为母婴安全保驾护航。
3.美国发现5800人接种疫苗后感染新冠病毒。当地时间4月15日,据美国疾控中心公布的数据显示,全美目前有约7700万人接种了两剂新冠疫苗,其中发现有5800人接种疫苗后感染新冠病毒,出现“突破性病例”。“突破性病例”中有396人需要住院治疗,以及74人死于新冠肺炎。在所有“突破性病例”中,超过40%的患者年龄在60岁以上。
4.牛津大学开展新的人体“挑战试验”。据CNN报道,英国牛津大学将启动一项为期一年的研究,让新冠肺炎康复者再次感染病毒,以确认是否会二次感染,并观察是否有特定的免疫反应在保护他们。该项研究的第一阶段将有64位志愿者参与。任何出现症状的志愿者将接受再生元的单克隆抗体治疗,并进行隔离,直到他们没有感染他人的风险。
审评动向
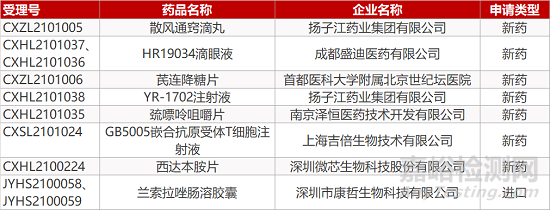
1. CDE新药受理情况(04月17日)
申请临床:
扬子江药业的散风通窍滴丸和YR-1702注射液、成都盛迪的HR19034滴眼液(2个规格)、首都医科大学附属北京世纪坛医院的芪连降糖片、南京泽恒的巯嘌呤咀嚼片、上海吉倍的GB5005嵌合抗原受体T细胞注射液、深圳微芯的西达本胺片。
申请生产:
深圳市康哲的兰索拉唑肠溶胶囊。
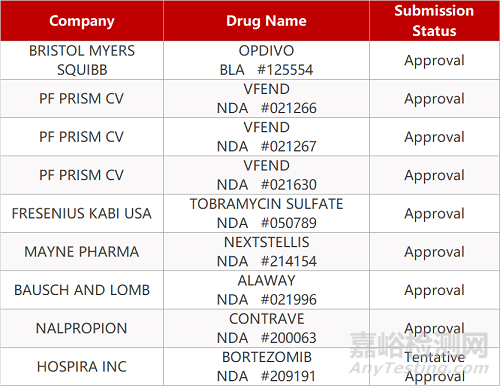
2. FDA新药获批情况(北美04月16日)
股市资讯
【苑东生物】(1)收到国家药监局签发的达比加群酯胶囊《药品注册证书》,该产品属于口服直接抗凝血药物,目前国内获批厂家有BoehringerIngelheim、江苏豪森、正大天晴等。(2)收到国家药监局签发的富马酸丙酚替诺福韦片《药品注册证书》,该产品主要用于治疗慢性乙肝,目前国内获批厂家有Gilead、成都倍特、江西青峰、齐鲁制药等。
【微芯生物】近日,公司收到美国FDA签发的关于允许西奥罗尼治疗复发/难治性小细胞肺癌临床试验开展的通知书。
【海辰药业】近日,公司收到国家药监局签发利伐沙班片的《药品注册证书》,该产品主要用于预防静脉血栓等。

来源:药研发


