您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-05-17 08:43
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:16条资讯,阅读时长约:3分钟 」
今日头条
上海璎黎的林普利司片NDA报产。璎黎药业新一代PI3Kδ抑制剂林普利司片新药上市申请(NDA)获CDE受理。这是璎黎药业创立以来递交的首个新药上市申请,也是林普利司的首个上市申请,针对的适应症为复发/难治滤泡性淋巴瘤患者。林普利司是该公司中美双报品种,去年4月已获FDA批准在美国开展Ⅱ期临床试验;林普利司片针对滤泡淋巴瘤和慢性淋巴细胞白血病两项适应症已分别获FDA孤儿药资格。目前,恒瑞医药拥有该新药在大中华区的联合开发权益以及排他性独家商业化权益。
国内药讯
1.渤健MS药物氨吡啶缓释片在华获批。渤健多发性硬化药物氨吡啶缓释片(fampridine)获国家药监局批准上市。Fampridine是一种钾通道阻滞剂,它通过改善跨脱髓鞘神经元的脉冲传导,来增强神经功能。2010年,氨吡啶缓释片获FDA批准,用于改善多发性硬化(MS)患者的步行能力,商品名为Ampyra(dalfampridine)。在中国,该新药已于2018年被纳入第一批临床急需境外新药名单。
2.中国首款mRNA疫苗启动Ⅲ期试验。云南沃森生物、苏州艾博生物以及军事科学院军事医学研究院共同研制的mRNA新冠疫苗ARCoV将于本月30日在墨西哥启动III期试验,预计有6000名志愿者参加。这也是中国首个进入III期临床的mRNA疫苗。目前全球共有两款mRNA疫苗获批,分别为BioNTech/辉瑞BNT162b2与Moderna公司mRNA-1273。储运温度条件分别为摄氏零下-70度(BNT162b2)和-20度(mRNA-1273)。而ARCoV疫苗可在2-8摄氏度环境下保存。
3.优时比IL-17A/F抑制剂在华启动Ⅲ期临床。优时比IL-17A/F单抗bimekizumab在中国登记启动了一项Ⅲ期临床。这是一项国际Ⅲ期临床,旨在评估bimekizumab治疗活动性中轴型脊柱炎、强直性脊柱炎和放射学阴性中轴型脊柱关节炎患者的安全性、耐受性和疗效。这项研究评估给药期长达112周,将在中国境内入组38人,在国际入组485人。主要研究者有上海长征医院的徐沪济教授、四川大学华西医院的赵毅博士等。
4.BMS递交LAG-3+PD-1复方的临床申请。百时美施贵宝LAG-3单抗Relatlimab和PD-1单抗纳武利尤单抗(Opdivo)组成的固定剂量复方注射液临床申请获CDE受理。今年3月,这一固定剂量复方疗法已在治疗转移性或不可切除的黑色素瘤初治患者的II/III期临床中,与Opdivo单药相比,达到无进展生存期(PFS)的主要终点。今年3月,默沙东TIGIT单抗vibostolimab和PD-1单抗pembrolizumab(帕博利珠单抗)组成的固定剂量复方制剂也在国内提交了临床申请。
5.合全药业与药明生物成立合资公司。药明康德子公司合全药业与药明生物宣布成立合资公司--药明合联。根据合资协议,药明生物和合全药业将各自出资1.2亿美元和8000万美元,分别持有药明合联的60%和40%股份。药明合联将成为药明生物的非全资子公司,提供从抗体和其他偶联生物药、连接子/有效载荷到生物偶联药物原液及制剂的合同研发生产服务(CDMO)。首席执行官由李锦才博士担任。
国际药讯
1.Heron公司新型非阿片类止痛药在美获批。FDA批准Heron公司创新止痛药Zynrelef(HTX-011,布比卡因/美洛昔康)缓释液上市,在成人患者进行拇囊炎切除术(bunionectomy)、开放性腹股沟疝修补术、全膝关节置换术后,对手术区域软组织或关节周围进行滴注,产生长达72小时的术后镇痛作用。Zynrelef是首款也是唯一一款FDA批准的缓释、双重作用局部麻醉药,它在术后72小时内能提供更好的疼痛控制和消除阿片类药物需求。
2.Apellis公司C3补体抑制剂在美获批。FDA批准Apellis公司Empaveli(pegcetacoplan)上市,用于治疗初治阵发性睡眠性血红蛋白尿症(PNH)成人患者,以及从接受C5抑制剂治疗转换为接受Empaveli治疗的PNH患者。这也是FDA批准用于PNH的首个C3靶向疗法。在一项Ⅲ期临床PEGASUS中,Empaveli在治疗第16周血红蛋白水平较基线的变化方面优效于活性对照组;在避免输血终点上与活性对照组相比达到非劣效性标准。
3.《柳叶刀》发表新冠疫苗“混合接种”安全性数据。《柳叶刀》最新发表一项英国大型随机试验评估阿斯利康新冠疫苗ChAdOx1 nCoV-19和辉瑞/BioNTech新冠疫苗BNT162b2的组合接种方案的初步安全性数据。数据显示,在两针同款疫苗接种的人群中,ChAd组第一针和BNT组第二针后,记录到的全身反应原性更高;相比两针同款疫苗,两种混合接种方案在第二剂后都引起了更明显的全身反应,但没有接种者由于这些症状而住院;同款接种和混合接种方案之间,接种者的血液学和生化特征相似;混合接种中出现的不良事件均为2级或更低,任何一组都没有血小板减少症发生。
4.Keytruda治疗早期三阴性乳腺癌达Ⅲ期双重主要终点。默沙东PD-1疗法Keytruda在治疗高风险早期三阴性乳腺癌患者的关键性Ⅲ期临床KEYNOTE-522达到双重主要终点。在这项研究中,Keytruda与化疗联用作为切除手术前的新辅助治疗,并且在手术后继续作为单药辅助治疗。中期分析显示,与单独新辅助化疗相比,这一治疗方案显著提高了无事件生存期(EFS)。此前,默沙东已报告这一试验达到了病理学完全缓解(pCR)的主要终点:与化疗对照组相比,Keytruda联合化疗组达到pCR的患者比例更高(64.8%vs51.2%)。
5.膀胱癌首创ADC在日获优先审查。日本厚生劳动省(MHLW)受理安斯泰来公司靶向抗癌药Padcev(enfortumab vedotin)的新药申请(NDA)并授予了优先审查,用于治疗接受抗癌药物治疗后病情进展的局部晚期或转移性尿路上皮癌(UC)患者。Padcev是一种nectin-4靶向抗体偶联药物(ADC),此前已获FDA加速批准上市,是全球首个获批治疗UC的ADC药物,也是首个获批用于先前接受过含铂化疗和一种PD-1或PD-L1抑制剂的局部晚期或转移性UC患者的药物。
6.渤健眼科基因疗法Ⅱ/Ⅲ期临床失败。渤健(Biogen)宣布AAV8基因疗法cotoretigene toliparvovec(BIIB112)治疗X连锁视网膜色素变性的Ⅱ/Ⅲ期XIRIUS研究(NCT03116113)结果未达到主要终点。采用黄斑完整性评估(MAIA)微视野计进行评价,在10-2网格16个中心位点中的≥5个位点,接受治疗的研究眼较基线改善≥7dB的比例没有达到统计学上的显著改善;但在几个次要终点方面观察到积极趋势。详细结果将在科学会议上公布。
医药热点
1.第八版新冠肺炎防控方案发布。《新型冠状病毒肺炎防控方案(第八版)》日前发布。新的方案强化入境人员、密接接触者等隔离医学观察管理,要求隔离医学观察期间应采集鼻咽拭子进行核酸检测,解除隔离时应同时采集2份鼻咽拭子样本,分别使用不同核酸检测试剂检测,两次检测原则上由不同检测机构开展。解除隔离后的第2天和第7天各开展一次核酸检测,期间做好健康监测,减少流动。
2.北京协和医学院天津校区即将开建。天津市与中国医学科学院北京协和医学院日前签署了合作协议,共建中国医学科技创新体系核心基地天津基地。在静海区团泊新城的中日(天津)健康产业发展合作示范区内共建中国医学科学院天津医学健康研究院、北京协和医学院医学中心和北京协和医学院天津校区,在滨海高新区的海泰渤龙产业园内共建成果转化及产业集群。
3.印度多地计划使用抗寄生虫药物治疗新冠。据路透社13日报道,印度至少有两个邦已经表示,他们计划向民众提供抗寄生虫药伊维菌素治疗新冠肺炎,因为目前病情危重患者太多,已经超出了医院的可承受能力。世卫组织在3月下旬的一份声明中曾表示,“对于将伊维菌素用于新冠肺炎的治疗,目前尚无定论。除非有更多数据可用,世卫组织建议仅在临床试验中使用该药物。”
4.美国或禁止资助参与中国人才计划的学者。美国国会参议院商务、科学和运输委员会日前以24票赞成、4票反对的结果通过“无尽边界”(Endless Frontier Act, EFA)法案,计划在五年内向美国国家科学基金(NSF)和能源部调拨1100亿美元的科研经费,并将禁止任何参与中国、俄罗斯、朝鲜或伊朗资助项目的学者获取来自美国联邦政府的新资助,这些科学家“在可能的范围内”也将被禁止参与其同事的资助项目,或从所在单位获得的其他国家经费中受益。
审评动向
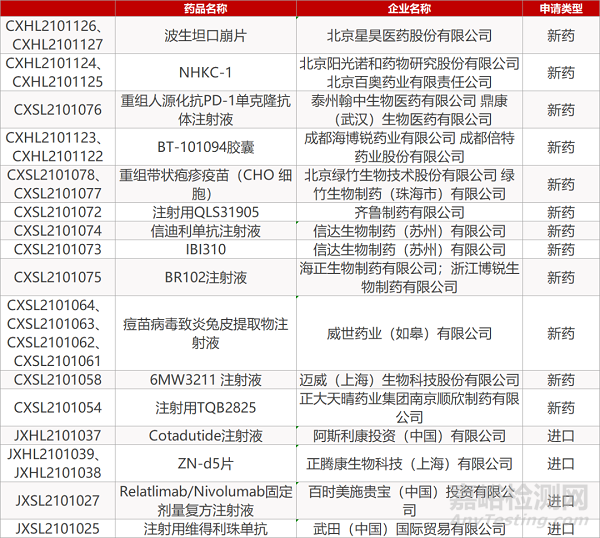
1. CDE新药受理情况(05月13日)
申请临床:
北京星昊的波生坦口崩片(2个规格)、北京阳光诺和公司/北京百奥药业的NHKC-1(2个规格)、泰州翰中生物/鼎康(武汉)的重组人源化抗PD-1单克隆抗体注射液、成都海博锐/成都倍特药业的BT-101094胶囊(2个规格)、北京绿竹/绿竹生物制药(珠海市)的重组带状疱疹疫苗(CHO 细胞)(2个规格)、齐鲁制药的注射用QLS31905、信达生物的信迪利单抗注射液和IBI310、海正生物/浙江博锐的BR102注射液、威世药业的痘苗病毒致炎兔皮提取物注射液(4个规格)、迈威(上海)的6MW3211 注射液、正大天晴的注射用TQB2825、阿斯利康的Cotadutide注射液、正腾康生物的ZN-d5片(2个规格)、百时美施贵宝的Relatlimab/Nivolumab固定剂量复方注射液、武田的注射用维得利珠单抗。
申请生产:
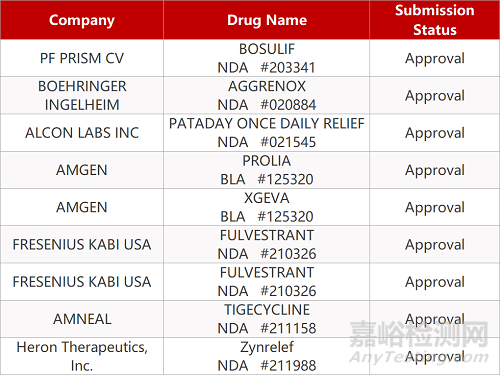
2. FDA新药获批情况(北美05月14日)

来源:药研发


