您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-03 12:33
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
齐鲁抗癌多肽获批临床。齐鲁制药“first-in-class”多肽药物注射用CEND-1(iRGD)获国家药监局临床试验默示许可,拟联合吉西他滨和注射用紫杉醇(白蛋白结合型),用于一线治疗晚期转移性胰腺癌。公布于ESMO2020大会上的一项Ⅰ期临床结果显示,CEND-1与吉西他滨和白蛋白紫杉醇构成的三联疗法,在转移性胰腺癌患者中达到59%的总缓解率,以及83%的疾病控制率。
国内药讯
1.德琪「塞利尼索」在韩国获批上市。韩国食品医药品安全部(MFDS)通过优先审评程序批准德琪医药口服型XPO1抑制剂塞利尼索(XPOVIO®,selinexor)上市,联合地塞米松用于治疗已接受至少四种既往治疗的复发或难治性多发性骨髓瘤(rrMM)成人患者,以及单药治疗既往接受过至少2线治疗的复发难治性弥漫性大B细胞淋巴瘤(rrDLBCL)的成年患者。塞利尼索是目前首款且唯一一款获FDA批准的口服XPO1抑制剂,也是首款可用于治疗rrMM和rrDLBCL的药物。
2.舒泰神注射用STSP-0601上II期临床。舒泰神凝血因子X激活剂「注射用STSP-0601」登记启动一项II期临床,主要探索和评价注射用STSP-0601多次给药用于伴抑制物血友病患者的安全性、耐受性及出血患者按需治疗的有效性,以及STSP-0601多次给药在患者中的药效动力学和药代动力学特征。该项目目标入组42人,主要研究者由中国医学科学院血液病医院张磊博士担任。
3.天士力抑郁症新药获FDA临床许可。天士力全资子公司天士力(北美)药业JS1-1-01片获FDA批准,即将开展用于治疗中重度抑郁症的临床试验。JS1-1-01是一种全新结构的5-羟色胺–去甲肾上腺素–多巴胺三重再摄取抑制剂(SNDRIs),该公司拥有涵盖JS1-1-01化合物、工艺、适应症及制剂的专利,其化合物专利已在中国、欧洲、美国等目标市场取得。目前,JS1-1-01片正在国内开展I期临床。
4.绿叶新一代VMAT2抑制剂在美报IND。绿叶制药自主研发的新一代VMAT2抑制剂LY03015在美国提交了临床试验申请,即将进入I期临床阶段,在120位健康受试者中评估单次口服的安全性、耐受性和药代动力学特征。LY03015拟用于治疗迟发性运动障碍(TD)、亨廷顿舞蹈病(HD),为绿叶制药基于其新分子实体/新治疗实体技术平台(NCE/NTE)开发的中枢神经领域创新药。
5.海思科创新药HSK21542获批临床。海思科宣布外周Kappa受体激动剂HSK21542注射液获国家药监局临床试验默示许可,即将开展“肝病瘙痒”的Ⅱ期临床试验。HSK21542是该公司自主研发的新分子实体化合物,拟用于镇痛、慢性肾脏疾病相关性瘙痒的治疗等。目前,HSK21542 已完成两项健康人I期临床试验,其他已申请的IND包括两个适应症,分别为急慢性疼痛(Phase Ⅲ进行中)及瘙痒适应症(Phase Ⅱ进行中)。
国际药讯
1.再生元新冠抗体鸡尾酒获EUA。FDA更新再生元(Regeneron)中和抗体鸡尾酒疗法REGEN-COV(casirivimab和imdevimab)的紧急使用授权(EUA),允许它用于尚未完全接种疫苗或预计对疫苗不能产生足够应答、有高风险进展为严重COVID-19的人群的暴露后预防治疗。这是首款获FDA批准同时用于治疗COVID-19患者和作为暴露后预防治疗的新冠中和抗体。在一项关键性Ⅲ期临床中,新冠病例密接者出现症状的COVID-19的风险降低81%。此外,REGEN-COV对Delta等突变株也保持良好的中和能力。
2.AD抗体疗法将启动真实世界研究。渤健与卫材开发的Aβ单抗Aduhelm(aducanumab)将开展真实世界Ⅳ期临床,评估用于治疗阿尔茨海默病(AD)患者的长期有效性和安全性。名为ICARE AD-US的研究是首项前瞻性研究,预计为期9年,将评估接受aducanumab治疗的患者的认知、功能和神经精神状态在真实世界的长期变化,以及安全性特征。另一项确认性试验将用于验证aducanumab的临床效果,满足Aduhelm获得加速批准的上市后附加要求。
3.武田创新疗法获FDA突破性疗法认定。FDA授予武田口服食欲肽(orexin)激动剂TAK-994突破性疗法认定,用于治疗1型发作性睡病(NT1)患者的过度日间嗜睡(EDS)。此前,这款药物的静脉输注剂型TAK-925已在概念验证Ⅰ期临床中,表现出维持NT1患者清醒的疗效。TAK-994目前正在Ⅱ期临床试验中接受评估,其研究数据将在未来科学会议上展示。
4.礼来公布AD抗体疗法最新分析。礼来在AAIC-2021上公布阿尔茨海默病(AD)抗体疗法donanemab在Ⅱ期临床TRAILBLAZER-ALZ的两项最新探索性分析。此前该项研究已显示出,donanemab能够缓解早期AD患者的认知和日常生活能力的衰退速度。新数据分析显示,接受donanemab治疗后患者的淀粉样蛋白沉积改变幅度越大,认知能力下降的速度越慢。第二项分析显示,donanemab同时迅速导致患者血浆中的P-tau217水平下降,这是反映AD病理学的一个生物标志物。
5.Alnylam联手PeptiDream开发多肽偶联siRNA。Alnylam公司和PeptiDream将利用PeptiDream的多肽发现平台系统(PDPS),共同发现和开发多肽-小干扰核糖核酸(siRNA)偶联疗法。根据协议,Alnylam将为PeptiDream的PDPS平台选择一组受体,而PeptiDream将为每个受体选择、优化和合成多肽配体,然后Alnylam再负责生产肽-siRNA偶联药物,并进行体外和体内研究。PeptiDream将获得预付款和研发经费,以及基于实现特定开发、监管和商业里程碑的后续付款,总额可能高达22亿美元。
6.BMS与BridgeBio开展联合用药研究。BridgeBio公司新型SHP2抑制剂BBP-398拟与百时美施贵宝(BMS)PD-1疗法Opdivo(欧狄沃,nivolumab,纳武利尤单抗)开展一项Ⅰ/Ⅱ期研究,以评估BBP-398+Opdivo二联疗法、BBP-398+Opdivo+KRASG12C抑制剂三联疗法,作为一线和二线治疗选择,治疗KRAS突变的非小细胞肺癌(NSCLC)的安全性和初步疗效。根据非独家合作条款,BridgeBio将赞助该研究,百时美施贵宝将提供Opdivo;两家公司将共同承担联合试验的临床开发活动费用。
医药热点
1.大连将恶性肿瘤门诊内分泌治疗纳入医保报销。为减轻恶性肿瘤患者的门诊医疗费用负担,自8月1日起,大连将恶性肿瘤门诊内分泌治疗纳入医保报销,报销比例为65%至85%。各类参保人员统筹基金年度最高支付限额均为6000元。恶性肿瘤内分泌治疗定点医疗机构为具有治疗该病资质的医疗保险定点医疗机构,参保人员可以到任意一家就医。
2.首位中国学者荣获AD研究领域大奖。宣武医院神经疾病高创中心主任、首都医科大学神经病学系主任贾建平获颁2021年国际阿尔茨海默病(AD)协会Zaven Khachaturian科学成就奖。据悉,这是首位获得此殊荣的中国学者。2005年,贾建平在国际上报道首例中国家族性阿尔茨海默病,系统研究了基因变异机制,开拓了AD遗传研究新方向。他共报告了90多个基因变异及其发病机制;创建AD早期识别和预测方法;开发出了6种可以在症状出现前5至7年预测AD的生物标志物。
3.中科院院士增选候选人名单公布。2021年中科院院士增选通信评审工作已结束,生命科学和医学学部共36人入选。根据公示,中科院系统10人、中国人民解放军军事科学院3人、北大3人、浙大2人、武汉大学2人、华中科技大学2人、首都医科大学2人、中国人民解放军总医院2人、东南大学1人、清华大学1人、厦门大学1人、上海交大1人、温州医科大学1人、云南大学1人、空军军医大学1人、中国农科院1人、北京协和医学院1人、四川省人民医院/电子科技大学1人。
审评动向
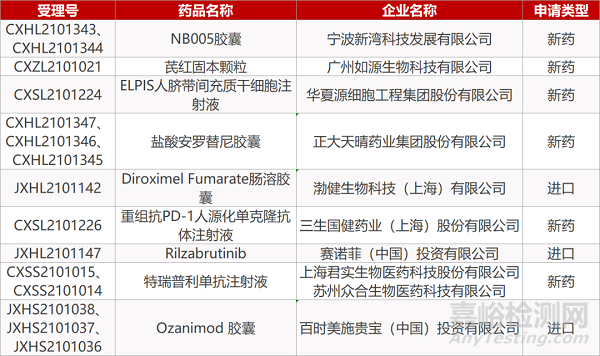
宁波新湾的NB005胶囊(2个规格)、广州如源的芪红固本颗粒、华夏源细胞工程集团公司ELPIS人脐带间充质干细胞注射液、正大天晴盐酸安罗替尼胶囊(3个规格)、渤健生物的Diroximel Fumarate肠溶胶囊、三生国健的重组抗PD-1人源化单克隆抗体注射液、赛诺菲的Rilzabrutinib、。

来源:药研发


