您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-20 13:37
口服固体制剂的生产工艺对原料药的理化性质有重要要求。针对特定的原料药,对可生产性进行风险评估,进而合理选择最优的工艺路线,是制剂研究过程中的重要内容。系统的评估各要素,以及科学合理的选择标准对工艺路线的确定有重要的帮助。另一方面,随着高通量技术的发展,药物发现的化合物产出大大增加,系统结构化的可生产性评估方法对于选择最优化合物,降低项目的可生产性风险有重要帮助。模仿BCS系统,一些科学家正在尝试为API建立生产分类系统(MCS)。笔者特选择了一篇相关的文章,翻译了文中的重要部分,以飨读者。
本文译自《Aproposal for a drug product Manufacturing Classification System (MCS) for oralsolid dosage forms》

基于药物工艺路线的生产工艺分类系统(MCS)
一般而言,可以通过两种方法克服不良的 API性质:第一,通过添加功能性辅料,特殊设计以改进可生产性。然而,仅仅添加辅料可能无法克服API的不良性质,尤其是在制剂载药量较高的情况下。第二种方法是通过制粒手段,形成更为致密、尺寸更大的粒子,使其更易于加工。2013年5月召开的药物科学学术会议中,考虑了建立MCS的不同的框架,最终确定,根据工艺路线开发MCS系统。这种结构化的方法将会帮助制剂开发者应对共同的挑战:对于特定的API如何合理的选择最优的工艺路线。此外,MCS可以帮助确定API的开发目标和设计优化,而后使用简单的工艺进行处理。我们现在正在精心收集各个不同的工艺路线的更多细节,进而形成MCS的基础。
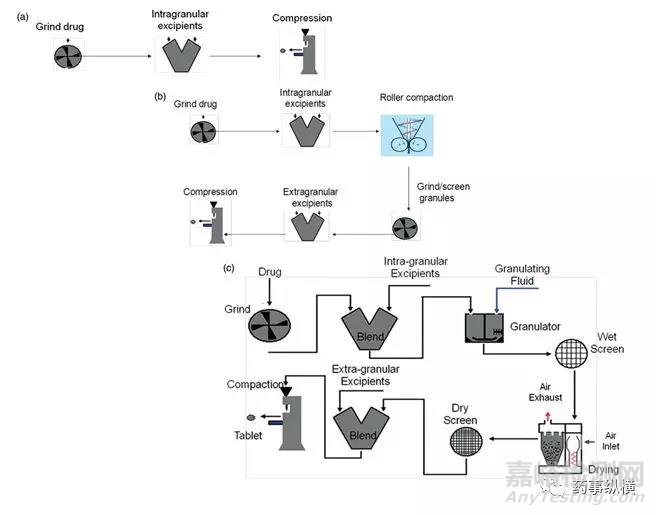
图1 三种主要的通用口服固体制剂工艺路线
在图1(a-c)中总结了通用口服固体制剂的三种主要工艺路线。这三种工艺路线,以及第四种其他分类,组成的MCS的基础:
(1)直压工艺;
(2)干法制粒;
(3)湿法制粒;
(4)其他工艺。
MCS遵循BCS类似的理念。最为简单的工艺处于第1类的位置。正如图1中所示,从第1类到第3类,工艺步骤、复杂性和生产成本逐渐增加。各个工艺能够承受API的不良性质的能力也是随着第1类到第3类逐步增加。然而,工艺越复杂,API面对的影响因素越多。这些影响因素包括粉碎和辊压过程中的剪切,湿法制粒时的湿气暴露,干燥和包衣过程中的加热。目前已知这些影响因素会造成一些API的变化,从而引发问题。另外一个复杂的问题在于:当问题发生时,多步骤工艺让确定问题发生的根源变得极富挑战性。第4个分类被建议用来包含更为复杂的工艺路线,例如,熔融造粒、活性物质包衣和喷雾干燥等。
物理性质:载药量和渗透概念
制剂载药量越高,API的性质更容易影响可生产性以及制剂成品的性质。这对制剂生产产生显著影响。当API的量达到某一水平,API的性质将会影响最终制剂成品性质的水平称为渗阈值。该性质受API的表面性质或体积性质(体积或重量)属性的影响。
通常认为,本体性质的渗阈值可能会随着API的性质不同而改变,例如粒径、形状、表面和机械性能。因此,对于特定的API,其渗阈值需要通过该API的数据进行确认。渗阈值可以通过数据确定。这些数据可以通过实验获得,也可以通过采用渗透原理工具的模型获得。确定渗阈值时,与性质相似的API进行比较可以帮助确定渗阈值。例如,混合工序中包含微粉化后的API时,由于API的小粒径和高表面积,流动性差和会产生表面粘附。从经验来看,渗阈值一般比较低,载药量大于20%时,包含微粉化API的物料在直压或干法工艺中会产生问题。理想状态下,为了保证稳健性,处方设计应当保证恰当的缓冲范围,远离渗阈值。靠近渗阈值的处方将面临风险。制剂会对API颗粒性质的变化而变得敏感。超出渗阈值越多,API的性质的影响越大。类似的,如果参数在渗阈值之内,工艺可能越稳健,进而能够适应API的改变。需要注意的是,一些材料的表面性质产生的影响与本体性质产生的影响并不成比例,例如硬脂酸镁。
可开发性概念
粉末直压和干法制粒被认为同属致密化的范畴,因此它们所期望的性质有重合的部分,并且随着生产工艺的不同,风险等级发生变化。湿法制粒,无论是通过低速剪切、高速剪切和一步制粒的方法,都涉及到对API的更为重大的改变。但一般而言,API的初始性质,是影响工艺参数的重要因素。其他方法的分类,是针对不能通过以上三种传统工艺生产的物料。根据API不同的特性,将采用许多可能的技术,我们将在一个专门的章节对其进行讨论。在这个分类中,二次加工使API的性质发生改变,最终的组成(单独的API或API与辅料共加工)才是关键。这个分类在后面将会进行描述,包括低溶解度、低熔点(包括在室温下为液体的API)、采用制粒不能改善流动性的低密度材料,以及不能充分压缩的API。实际上,MCS能够帮助确立所期望的物料属性,以便其适合后续的粉末直压、干法制粒或湿法制粒。
可开发性的概念是用于评价API的剂量和物理化学性质如何有助于或阻碍任一制剂形式的开发。表1中总结了适合粉末直压、干法制粒或湿法制粒的理想API的性质。任何分子都不大可能同时用于这些理想的性质。但是,离这些理想性质的差距越大,开发的难度和风险会越大,同时生产中将会运用到更多的控制策略。在可能的地方给出了这些理想性质的参考标准。但是,需要注意的是,一些值并非来源于文献,而是代表着目前最佳的商业实践。因此它们被认为是讨论的起点。一些参数可能不适用于所有的开发和生产指标,同时对于特定剂型下的特定API,可能也会有特殊的考虑。应当基于个别的化合物的性质进行风险评估,以确定这些标准的相关性是否正确。
可开发性参数
开发的剂量
通常认为剂量低于50mg,毒理学的风险比较低。这一结果与任何渗阈值无关。在考虑可加工性时,需要注意剂量小于1mg时,含量均匀度合格将是巨大的挑战。高剂量的挑战来自于病人的依从性。大的药片可能造成吞咽困难,目前市售的制剂重量上限大约是1.5g。
粒子尺寸
D50在50~500微米的范围内适合于压片。更低粒径下,可能会发现静电、流动性差和粘附问题。粒径更大,控制胶囊和片剂的重量将面临挑战。然而,通过恰当的工艺策略,可以加工更低粒径的粒子。
形态
针状和片状更富有挑战性;因此横纵比接近1:1:1更佳。表面的光滑度和粗糙度也是影响因素,尤其是在极端条件下。例如,非常光滑的粒子,可能带来挑战,因为它们可能从载体中分离,从而导致含量均匀度方面的挑战。
表面积
正如粒径和形态通常是重要参数,表面积是一个有用的参数,可以将二者结合起来,尤其是当发现表面化学效应的影响时很重要。
晶型
需要对晶型进行控制,缺乏对晶型的有效控制(例如转变为更为稳定的晶型)可能导致材料性质的改变,从而引发生产上的挑战,从而影响最终制剂的性质和稳定性。在下文中对API的晶型问题在第四类部分给出了一个例子。
密度
API的密度可以对生产的适合性进行描述。已经存在药典方法测定真实密度、堆密度和振实密度。粉末的密度能够有效地反映粉末的可压性、流动性和压实性上。
其他影响可开发性的参数
流动性
粒子的流动性对于产品和工艺的稳健性十分重要。卡尔指数或者压缩性是比较容易测定的,与药典中流动性的定义相关。更为复杂的测试,如剪切单元测试可以测定流动功能,内摩擦角和壁摩擦角可以对更为广泛的操作条件提供更为详尽的分析。
分离
粒子粒径、形状、表面电荷、粘附力和本体密度的不同可以引起分离。但是将这些值用于量化分离的风险是非常困难的,因为这些相互作用受到多因素影响。API粒径对含量均匀度的影响可以采用蒙特卡洛模拟进行评价。类似的,粒子分离对含量均匀度的影响可以用筛分方法评价。
可压性评价
成片性(强度 vs 压力)和可压性(强度vs 固相分数)是制粒后粒子或混合物的关键输出参数,它们取决于API、辅料和工艺。作为一般的指导原则,如果最终成品的强度大于1.7Mpa,固相分数小于0.9,那么制得的片在后续的流程中(例如包衣、包装,运输和病人的使用)是稳健的。片剂的固相分数的期望值是0.85±0.05。在这个范围以上,由于局部密度过高,裂片和顶裂的风险增大。如果片子的其他性质(例如碎脆度)可以接受,更低固相分数一般也不会出问题。
对API的性质进行更为深入的研究和分类,可以得到延展性、脆性、塑性、弹性、应变速率敏感性。这些数据的获取结果是设备和方法学依赖的,但是这些方法对于表征API是有用的。在图2中列出采用该方法的一个例子。
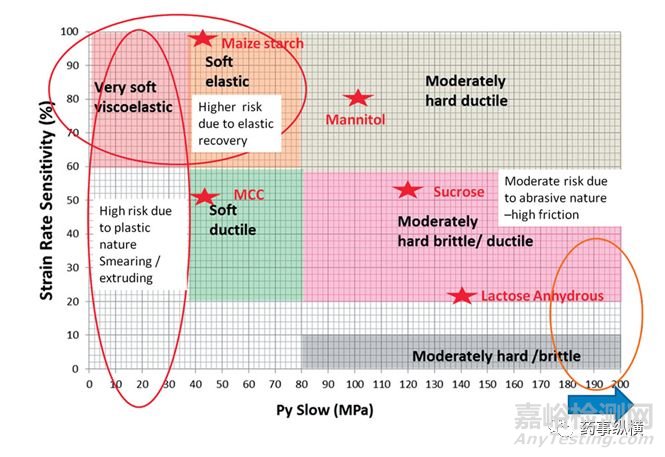
图2 根据材料性质对可压性进行分类
表面粘附
表面粘附的数值因为分析方法的不同而不同。可以采用不同的分析方法,例如直接测定粘附力,(如弹射力、脱落力),通过设备粘冲/模拟。粘附材料也可以通过视觉观察,例如光学显微镜、SEM或AFM。但是,这些试验获得的数据并不能完全代表动态环境下的行为,例如流动、混合等。其他一些方法包括粉末重量和含量分析。
表1 考虑采用粉末直压、干法制粒和湿法制粒工艺的API的理想性质

MCS建立的指导原则
MCS的目标在于根据现有的知识,基于材料的性质对生产风险进行分类。其目的并不是在于包含死的教条,而是提供一种风险评估指南,这种评估是基于剂型和推荐的工艺路线。随着前三个生产系统的递进,对API的初始性质依赖越小,制粒过程的目的在于使粒子的性质与表1中可开发性性质的理想范围更为接近。
关键的挑战在于将API的性质与处方粒子性质,以及由此引起的与生产工艺的相互作用。如果全部考虑所有的性质和可能的相互作用,那么任何分类系统可能都是极端复杂的。如果试图考虑所有的真实和理论上的因素,那么其价值和实用性将会降低。然而,初步开发这个分类系统的目标在于容易理解,但是仍然能够概括最为重要的方面。在建立之后,MCS系统可以被进一步开发拓展。
第1类:粉末直压
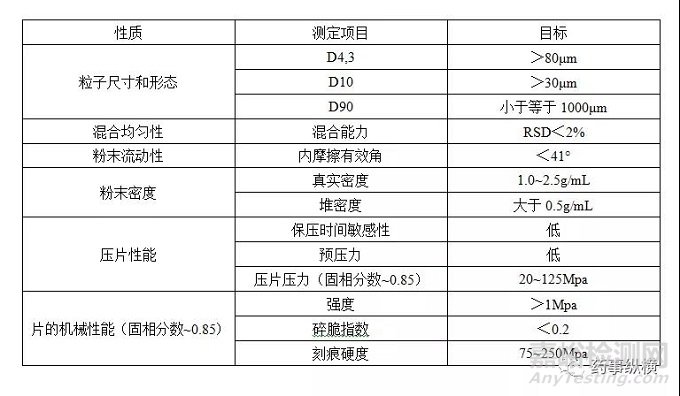
粉末直压仅仅包含两个主要步骤,相对于干法制粒和湿法制粒,更为简单。粉末直压的成功实现对API性质的依赖性最强。粉末直压进一步的挑战在于,API的性质不仅仅是可以接受,而是这些性质能够保持一致性。平均粒径和粒度分布,以及粒子性质对于粉末直压极为关键。与制粒方法相比,不合适的API粒径和形状,对于粉末直压是较大的障碍,因为没有后续的生产步骤用于减轻这些不良API性质的影响。Hancock在2004年建议理想的粉末直压材料应当具有的性质,如表2所示。MCS项目的进一步工作在于根据现有知识,更新这些标准。
表2 用于粉末直压材料的理想性质
第2类:干法制粒
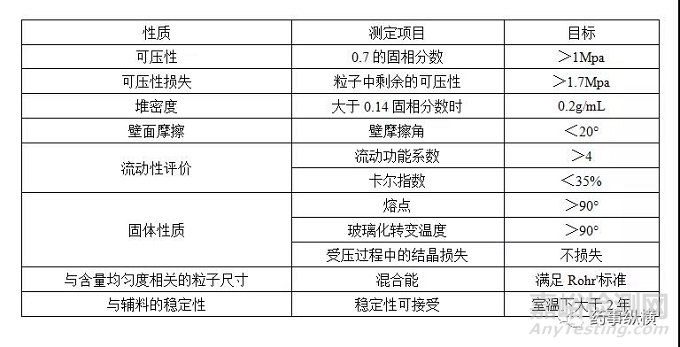
干法制粒,通常认为其比粉末直压对输入粒子的性质具有更大的容忍度。因为干法制粒过程,提供额外的压制步骤,API与其他辅料部分致密化而形成粒子。大部分适用于粉末直压的理想性质同样适用于干法制粒,除了与流动性或堆密度相关的性质。但是对于压缩性可能有限的材料而言,额外的压缩步骤可能是不利的。因此必须考虑部分致密化对处方的成片性的影响。对于这一影响的风险评估的方法有两种,确定干法制粒后粒子的成片性下降多少,或者保证剩余的成片性能足够,能够形成稳健的片剂,例如超过1.7Mpa。通常,压缩后的块状物的强度应当大于1Mpa,以保证粉碎过程中,粒子的强度足够。对于弹性材料而言,干法制粒可能比粉末直压更好,因为干法制粒采用更慢的压缩过程,可能去除部分弹性(应变速率敏感性)。这使得形成的粒子可能在压片过程中表现得更为优异。可能需要考虑的性质在表3中列出。
表3 用于干法制粒材料的理想性质
第3类:湿法制粒
湿法制粒比干法制粒或粉末直压,更为复杂,但是可以处理API的性质更为宽广,可以将API转变为具有优异性质的粒子,方便下游加工。考虑到工艺变量的宽广范围和复杂性,这里考虑的主要湿法制粒方法是高速剪切,相对于其他方法如流化床,热熔等,高速剪切应用更为广泛。
另一个假设是制粒的液体是水或水/共溶剂。运用渗阈值的概念,一些物理性质对湿法制粒是较强的驱动力。表4中提供了一个例子,用于阐述风险评估的基本要素,同时也包含了不确定的范围。
表4 湿法制粒(WG)的关键考虑
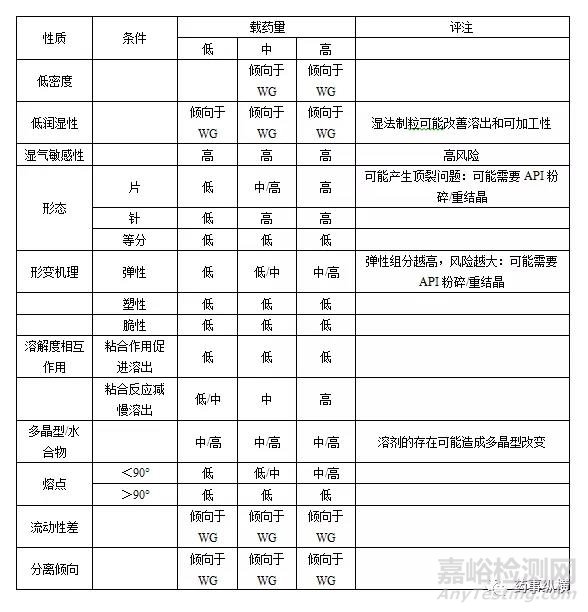
第4类:其他技术
其他技术是指需要采取其他策略,由于API的性质在可开发性标准之外。此外,需注意到这些技术并不会单独用于改善生产性。通常认为,这些策略的主要目的在于提高生物利用度,例如无定型喷雾干燥分散体(SSD),可能产生的次要效应即是改善API的可加工性。
这一类包含了多样化的技术,并采用举例说明,同时也并不会完全列举。我们强调了一些例子,API的性质使其不适合采用传统的生产工艺。仅描述了用于接近商业规模生产上应用的技术。
高载药量,湿气敏感的API
在湿法制粒过程中,API处于的温度在API熔点之下,而在粘合剂的熔点或玻璃化转变温度之上。在一个研究中描述了一种难溶性抗肿瘤候选药物的生产工艺变化过程。由于API是湿气敏感,湿法制粒并不可行。与湿法制粒相比,熔融制粒方法获得的粒子细粉更少,流动性得到改善。imatinib和metformin在载药量高达90%时,能够得到令人满意的颗粒。
易于降解的API
采用传统的方法制备PPAR(过氧化物酶体增殖剂激活受体)激动剂peglitazar是不可能的,因为其在酸碱催化条件下降解。活性薄膜包衣技术被探索用于该药物的制备。这种技术将药物加到包衣膜材料中,并将之喷洒到片芯上。由于在包衣膜包含非反应性的包衣材料,且其中药物和辅料的比例比传统的干法和湿法制粒更高,该方法可以获得化学稳定性满意的片剂。
高活性API
高活性药物会带来安全性挑战,尤其是处理粉末形式的药物时。此外由于其剂量较低,也会带来含量均匀度上的挑战。对湿法制粒工艺进行改进,将API溶于制粒液体中即可克服这一问题。如果这个方法也不可行,那么液体分散体技术(LDT)可以应用,该方法中,药物的溶液被沉积在惰性的片芯上。
晶型挑战
抗艾滋病药物增强剂可比司他,并非是通过结晶形式分离的,而是低玻璃化转变温度转化为无定型吸湿性固体形式。在外界条件下,这种形式很容易发生转晶,通过湿气或者温度的驱动发生相转变,形成一种难以加工的橡胶态材料。除去水分后也不能使其转变回原来的状态。在API分离的过程中,将二氧化硅加入到该API的溶液中,在蒸发过程时,API被吸附进入二氧化硅中,从而获得可以自由流动的粉末。尽管仍然具有吸湿性,但吸湿过程是可以可逆的,不会再发生相转变。
另外一个关于API的型式问题是API在室温下是液体状态。为了采用标准的生产技术,通常需要加入大量的辅料将API转变为合适的粉末,而生产出不实用的大剂型。液体或半固体填充胶囊可以克服这一挑战,且已经被应用于很多商业化产品,例如鱼油和维生素E等。
译后语
熟知制剂工艺路线对API性质的需求对于制剂工艺开发是十分关键的。一方面,对于特定的API,基于其理化性质,可以选择风险更低的工艺路线,在进行处方设计时,也能够明确理化性质需要改进的方向。另一方面,根据API的理化性质,可以决定晶/盐型甚至化合物的取舍,或者至少可以评定风险等级,以便做出更为优选的决策。
就本文而言,其涉及的生产实践并不深入,但译者认为其建立的基本框架对制剂开发具有很好的指导意义。其中很多概念,值得在具体的制剂开发设计中进行考虑,尤其是在新药制剂的开发过程中。例如,早期的制剂开发过程中,制剂最终规格往往是无法确定的。基于对渗阈值的理解,不同规格制剂的开发可能实现巧妙的衔接。再例如文中提到的基于材料性质对可压性进行分类,对处方设计时的辅料选择具有较好的指导作用。实质上,合理运用材料学的工具,无论是一些理论模型或者表征手段,对制剂的开发可能有重要的帮助。例如,有研究者采用DSC研究原辅料相容性。
最后,就长远发展的制药公司而言,译者相信其必然存在一套类似的评价方法,用以解决API的可生产性评价问题。而对于一些正在不断壮大的公司,以这样一个框架为起点,不断整合开发过程中所获取的知识和经验,也将获益匪浅。

来源:Internet


