您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-25 22:45
牙科或者口腔科临床使用车针,主要用来切削牙体组织,以达到去除病变组织,或者治疗钻孔或制备牙体。
一、车针的结构与工作原理
1.车针的结构
牙科车针主要由两部分组成:工作部分和连接的柄,如图1所示。
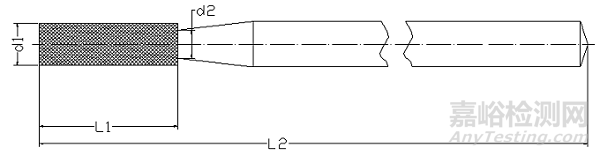
图1. 金刚砂车针(L1为工作部分,L2为柄部,相连接部分为颈部)
2.车针的工作原理
牙科车针是一种口腔治疗用旋转器械,不可独立使用,必需与牙科手机连接方可应用,与手机连接部分即为其柄或杆,柄或杆与手机的连接的方式分卡扣式和摩擦式。车针工作方式主要分为刃切削和磨料切削。刃切削的材料主要为硬质合金和不锈钢,而磨料切削目前主要为天然金刚石粉或金刚砂粉。
加工切削刃需要采取机械加工、研磨和热处理,切削刃的形状、数量和深度决定了切削的效率。而磨料切削是通过结合剂将磨料与基底材料结合到一起,通常的基底材料为不锈钢,磨料颗粒大小的不同产生不同的切削效果
二、车针的研发实验要求
1.医疗器械生物学研究:
因车针属于表面接触器械,与损伤表面接触,且与人体接触为短期接触,按GB/T 16886.1—2011,车针生物相容性建议评价以下项目:
a) 细胞毒性:应不大于1级;
b) 应无迟发型超敏反应;
c) 应无皮内反应。
2.生物安全性研究、动物研究、软件研究
不适用。
3.灭菌和消毒工艺研究
牙科车针如无菌供应,灭菌研究应符合GB 18278.1—2015《医疗保健品灭菌 湿热 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求》、GB 18279.1—2015《医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求》、GB/T 18279.2—2015《医疗保健产品的灭菌 环氧乙烷 第2部分:GB 18279.1应用指南》、GB18280.1—2015《医疗器械保健产品灭菌 辐射 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求》、GB 18280.2—2015《医疗保健产品灭菌 辐射 第2部分:建立灭菌剂量》、GB/T 18280.3—2015《医疗保健产品灭菌 辐射 第3部分:剂量测量指南》的规定。
牙科车针如由医疗机构清洗消毒,应进行清洗消毒方法相应的研究,应符合WS 310.1—2016《医院消毒供应中心 第1部分:管理规范》、WS 310.2—2016《医院消毒供应中心 第2部分:清洗消毒及灭菌技术操作规范》、WS 310.3—2016《医院消毒供应中心 第3部分:清洗消毒及灭菌效果监测标准》及WS/T 367—2012 《医疗机构消毒技术规范》的要求。
4.有效期和包装研究
无菌供应的牙科车针可参考YY/T 0681.1—2009 《无菌医疗器械包装试验方法 第1部分:加速老化试验指南》进行包装研究。
5.主要性能指标
5.1.柄或杆的要求
车针的杆应符合YY 0761.1—2009、YY/T 0805.2—2014、YY/T 0805.3—2010、YY 0302.1—2010中的相应要求。重点审查对尺寸和材质的要求。
5.2.工作部分
5.2.1金刚砂车针
应符合YY 0761.1—2009、YY/T 0805.2—2014和YY/T 0805.3—2010的要求。
5.2.2钢质和硬质合金车针
应符合YY 0302.1—2010和YY 0302.2—2016的规定。
注册申请人对车针工作部分的要求是产品的核心,除对该部分要求做出符合有关标准要求的规定,并能够实现检测外,应对如何实现产品的品质要求、如何控制产品质量的关键点进行简要介绍。
5.3.工作部分的公称直径与编码
应符合YY/T 1011—2014《牙科 旋转器械-公称直径和标号》的规定。即工作部分的直径以一组三位数编码表示,以0.1mm为单位,如2mm直径的球钻,其公称直径编号即为020,18mm直径的金刚砂切盘,其公称直径编号即为180。
5.4.产品编码
注册申请人应注明其是否采用YY/T 0873系列标准对自己的产品进行编码,及如何编码进行说明,如金刚砂车针是采用15位还是18位编码。
5.5.无菌(若适用)
按照GB/T 14233.2—2005规定方法进行,应无菌。
5.6.环氧乙烷残留(若适用)
按照GB/T 14233.1—2008规定方法进行,残留量应不大于10μg/g。
三、相关标准
具体相关的常用标准列举如下:
表 1. 相关标准
|
标准编号 |
标准名称 |
|
GB/T 191—2008 |
《包装储运图示标志》 |
|
GB/T 9937.3—2008 |
《口腔词汇 第3部分:口腔器械》 |
|
GB/T 14233.1—2008 |
《医用输液、输血、注射器具检验方法 第1部分:化学分析方法》 |
|
GB/T 14233.2—2005 |
《医用输液、输血、注射器具检验方法 第2部分:生物学试验方法》 |
|
YY/T 1011—2014 |
《牙科 旋转器械-公称直径和标号》 |
|
YY 0761.1—2009 |
《牙科旋转器械 金刚砂车针 第1部分:尺寸、要求、标记和包装》 |
|
YY/T 0805.2—2014 |
《牙科学 金刚石旋转器械 第2部分:切盘》 |
|
YY/T 0805.3—2010 |
《牙科学 金刚石旋转器械 第3部分:颗粒尺寸、命名和颜色代码》 |
|
YY 0302.1—2010 |
《牙科旋转器械 车针 第1部分:钢质和硬质合金车针》 |
|
YY 0302.2—2016 |
《牙科学 旋转器械车针 第2部分:修整用车针》 |
|
ISO 7787-1—2016/ GB/T 36917.1-2018 |
《牙科 实验室刀具 第1部分:实验室钢制刀具》 |
|
ISO 7787-2—2000/ GB/T 36917.2—2018 |
《牙科旋转器械——切割工具 第2部分:技工室用硬质合金刀具》 |
|
ISO 7787-3—2017 |
《牙医 实验室刀具 第3部分 铣床硬质合金刀具》 |
|
ISO 7787-4—2002 |
《牙科旋转器械 切刀器 第4部分:小型硬质合金切刀》 |
|
YY/T 0874—2013 |
《牙科学旋转器械试验方法》 |
|
ISO 1797—2017 |
《牙科学 旋转和摆动仪器支架》 |
|
YY 1045.1—2009 |
《牙科手机 第1部分:高速气涡轮手机》 |
|
YY 1045.2—2010 |
《牙科手机 第2部分:直手机和弯手机》 |
|
YY/T 0873.1—2013 |
《牙科旋转器械的数字编码系统 第1部分:一般特征》 |
|
YY/T 0873.2—2014 |
《牙科 旋转器械的数字编码系统 第2部分:形状》 |
|
YY/T 0873.3—2014 |
《牙科 旋转器械的数字编码系统 第3部分:车针和刃具的特征》 |
|
YY/T 0873.4—2014 |
《牙科 旋转器械的数字编码系统 第4部分:金刚石器械的特征》 |
|
GB 18278.1—2015 |
《医疗保健产品灭菌 湿热 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求》 |
|
GB 18279.1—2015 |
《医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求》 |
|
GB/T 18279.2—2015 |
《医疗保健产品的灭菌 环氧乙烷 第2部分:GB 18279.1应用指南》 |
|
GB 18280.1—2015 |
《医疗器械保健产品灭菌 辐射 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求》 |
|
GB 18280.2—2015 |
《医疗保健产品灭菌 辐射 第2部分:建立灭菌剂量》 |
|
GB/T 18280.3—2015 |
《医疗保健产品灭菌 辐射 第3部分:剂量测量指南》 |
|
WS 310.1—2016 |
《医院消毒供应中心 第1部分:管理规范》 |
|
WS 310.2—2016 |
《医院消毒供应中心 第2部分:清洗消毒及灭菌技术操作规范》 |
|
WS 310.3—2016 |
《医院消毒供应中心 第3部分:清洗消毒及灭菌效果监测标准》 |
|
WS/T 367—2012 |
《医疗机构消毒技术规范》 |
|
YY/T 0681.1—2009 |
《无菌医疗器械包装试验方法 第1部分:加速老化试验指南》 |
四、主要风险
牙科车针的风险管理报告应符合YY/T 0316—2016《医疗器械 风险管理对医疗器械的应用》的有关要求。
表2. 危害清单
|
能量危害示例 |
生物学和化学 危害示例 |
操作危害示例 |
信息危害示例 |
|
线电压(网电源): 漏电流 -外壳漏电流; -对地漏电流; -患者漏电流。 电场; 磁场; 热能: 高温; 机械能: 重力 -坠落; -离心力。 振动: 运动零件; 患者的移动和定位。 |
生物学的: 细菌; 病毒; 其他微生物。 再次或交叉污染。 化学的: 工作部分接触唾液、龈沟液和牙体组织的溶解和磨损; 材料生锈。 生物相容性: 镍过敏反应。 |
功能: 不正确或不适当的速度输出或功能; 不正确的测量; 功能的丧失或变坏。 使用错误: 不遵守规则; 缺乏知识; 违反常规。
|
标记: 不完整的使用说明书; 性能特征的不适当的描述; 不适当的预期使用规范; 限制未充分公示。 操作说明书: 医疗器械所使用的附件的规范不适当; 使用前检查规范不适当; 过于复杂的操作说明。 警告: 副作用的警告; 一次性使用医疗器械可能再次使用的危害的警告; 服务和维护规范。 |
表3. 危害、可预见的事件序列、危害处境和可发生的损害之间的关系
|
危害 |
可预见的事件序列 |
危害处境 |
损害 |
|
能量危害 |
|||
|
电场 磁场 |
与车针共同使用的手机,设计不合理导致电磁场过大影响其他设备的运转。 |
其他设备运转故障。 |
设备故障 |
|
热能 高温 |
转动部分性能不稳定或冷却不够可能导致摩擦高温。 |
设备温度太高而烫伤病人或操作者。 |
烫伤 |
|
机械能 重力、离心力 -脱落 -甩针 振动 运动零件 患者的移动和定位 |
设计不合理,采购原料不合格,生产过程失控。如:车针柄的不合标准过细,造成手机的夹持力不足或夹轴失效操作时发生车针脱落;车针的同轴度不够,引起过大的振动或摆动。 |
错误的机械能或机械力施加到病人的组织。 |
机械损伤。 |
|
生物学和化学危害 |
|||
|
细菌 病毒 其他微生物 |
生产环境和产品清洁未控制好导致产品受污染。 |
使用过程中细菌、病毒或其他微生物进入患者的体内。 |
细菌、病毒等感染。
|
|
消毒、清洁 |
应用部件消毒不完全传染疾病。 |
交叉污染染。 |
传染高致病性疾病。 |
|
残留 |
材料所含化合物的迁移的化学剂生物学危害,清洁或消毒所用消毒剂的残留等。 |
重金属或有毒物质进入人体。 |
过敏或急性毒性反应。 |
|
操作危害-功能 |
|||
|
功能的丧失或变坏 |
产品导致功能丧失。如金刚砂车针脱砂,钨钢车针断刃等。 |
使用时导致无法正常使用。 |
治疗中断。
|
|
操作危害-使用错误 不遵守规则 缺乏知识 违反常规 |
错误的使用了产品。
|
损坏产品 或产生非预期的治疗结果。
|
治疗中断或失败。 |
|
重复使用 |
车针可重复使用,但应彻底消毒或灭菌,否则有微生物残留。 |
微生物交叉污染。 |
传染疾病。 |
|
信息危害-标记 |
|||
|
不完整的使用说明 性能特征的不适当的描述 |
1.使用说明书、标签等设计错误; 2.标签使用错误。 |
给用户在使用、操作上误导,导致无法正常使用。 |
治疗中断或失败。 |
|
不适当的预期使用规范 限制未充分公示 |
1.设计错误; 2.标签使用错误。 |
给用户在使用、操作上误导,导致无法正常使用。 |
治疗中断或失败。 |
|
信息危害-操作说明书 |
|||
|
使用前检查规范不适当 |
操作说明中注意事项未写明或标记不明显; 使用已损坏的产品; 使用了受污染的产品。 |
导致无法正常使用;或出现非预期的结果,如损伤组织,微生物污染等。 |
治疗中断或失败。 微生物感染。 |
|
信息危害-警告 |
|||
|
副作用的警告 |
禁忌症的警告未写明或标未不明显; 违反禁忌症使用了产品。 |
患者因治疗发生意外。 |
患者损伤或治疗失败。 |
|
一次性使用医疗器械可能再次使用的危害的警告 |
未写清或标示不明显; 重复使用。 |
使用过程中细菌进入患者的体内。 |
交叉感染。 |

来源:嘉峪检测网


