您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-26 10:34
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
腾盛博药新冠鸡尾酒Ⅲ期临床积极。腾盛博药新冠中和抗体组合疗法(BRII-196/BRII-198)治疗出现症状后10天内入组的高风险COVID-19门诊患者的国际Ⅱ/Ⅲ期ACTIV-2试验结果积极。与安慰剂相比,BRII-196/BRII-198将住院及死亡的复合终点降低78%,具有统计学显著性,相对危险度 (RR): 0.22 (95%置信区间: 0.05, 0.86),P值<0.00001 (未调整,单侧检验)。其他亚组分析将进一步评估首发症状后5天内使用BRII-196/BRII-198治疗相比首发症状后6-10天使用的效果。
国内药讯
1.礼来雷莫西尤单抗新适应症报NDA。礼来雷莫西尤单抗(雷莫芦单抗,Ramucirumab)新适应症上市申请获CDE受理,推测申请的适应症为二线肝细胞癌。Ramucirumab是一种VEGFR-2单抗药物,最早于2014年11月获FDA批准上市,商品名为CYRAMZA,目前其已获批5项适应症:胃癌、非小细胞肺癌、结直肠癌、肝细胞癌和EGFR突变晚期/转移性非小细胞肺癌。
2.恒瑞JAK1抑制剂治疗斑秃II期临床积极。恒瑞旗下瑞石生物JAK1抑制剂SHR0302片治疗斑秃的II期临床RSJ10521(CRYSTAL2)达主要终点。与安慰剂相比,SHR0302(8mg和4mg)治疗组24周达到秃发严重度评分工具(SALT)评分较基线变化的百分比显著更高。目前,SHR0302还在多项临床中评估用于治疗类风湿性关节炎、溃疡性结肠炎、克罗恩病等疾病的潜力;SHR0302用于特应性皮炎的适应症已获CDE纳入突破性疗法认定。
3.歌礼FXR激动剂治疗乙肝上II期临床。歌礼FXR激动剂ASC42完成慢性乙型肝炎(CHB)适应症中国桥接试验(NCT04965337)。共30名健康受试者接受ASC42或安慰剂治疗,结果显示中国和美国受试者间具有一致的药代动力学特征;ASC42在中国受试者中安全性和耐受性良好,未出现2级及以上严重不良事件(SAEs)。目前ASC42已启动用于慢性乙型肝炎治疗的中国II期临床,剂量确定为10 mg和15 mg,每日给药一次,与聚乙二醇干扰素及核苷(酸)类似物联用。
4.伊尼妥单抗联合CD47免疫疗法获批临床。三生国健HER2单抗赛普汀®(伊尼妥单抗)与宜明昂科CD47融合蛋白IMM01的组合方案,获国家药监局临床试验默示许可,即将开展一项用于治疗HER2+实体瘤患者的Ib/II期临床。赛普汀®是罗氏曲妥珠单抗的生物类似物,是首个国产HER2单抗。三生国健正在开展多项临床,评估与其他创新药物联用,拟扩展伊尼妥单抗的临床适应症。
5.CDE征求3项研究技术指导原则意见。8月24日-25日,CDE官网发布3则通知,公开征求相关研究技术指导原则意见。分别为《改良型新药调释制剂临床药代动力学研究技术指导原则(征求意见稿)》、《新药研发过程中食物影响研究技术指导原则(征求意见稿)》、《创新药人体生物利用度和生物等效性研究技术指导原则(征求意见稿)》。
国际药讯
1.乌帕替尼获欧盟批准治疗湿疹。欧盟委员会批准艾伯维口服JAK抑制剂乌帕替尼 (Rinvoq)扩展适应症,单药或与外用皮质类固醇(TCS)联用,治疗适合全身性治疗、≥12岁的中/重度特应性皮炎患者。在Ⅲ期研究中,与安慰剂相比,乌帕替尼组达到湿疹面积和严重程度指数改善75%(EASI 75)和皮肤症状清除/几乎清除(vIGA-AD 0/1)的患者显著更多;达到瘙痒减轻(NRS改善≥4)的患者也显著更多。据悉,这是首款获批治疗特应性皮炎的JAK抑制剂。
2.创新TCR疗法获FDA优先审评。FDA受理Immunocore公司TCR/CD3双特异性融合蛋白tebentafusp(IMCgp100)的生物制品许可申请(BLA),用于治疗HLA-A*02:01阳性的转移性葡萄膜黑色素瘤(mUM)成人患者。FDA同时授予其优先审评资格。在一项Ⅲ期临床IMCgp100-202中,tebentafusp降低患者死亡风险49%(HR=0.51,95% CI (0.37, 0.71);P<0.0001)。欧盟EMA也受理了tebentafusp的监管申请,并将通过加速评估程序对其进行评估。
3. BCMA靶向CAR-T早期临床积极。Cartesian公司BCMA-CAR-T疗法Descartes-08在治疗全身性重症肌无力(gMG)患者的Ⅰb/Ⅱa期临床中获积极结果。试验结果表明,Descartes-08耐受性良好,没有报告细胞因子释放综合征(CRS)或其他严重的产品相关不良事件;所有患者在评估整体疾病严重程度重症肌无力综合(MGC)量表上显示出显著改善。在给药约三个月后,Descartes-08组的MGC量表平均改善超过50%。
4.默克M7824治疗BTC的II期临床失败。默克宣布终止TGF-β/PD-L1双功能融合蛋白bintrafusp alfa联合吉西他滨和顺铂一线治疗局部晚期或转移性胆道癌(BTC)的II期INTR@PID BTC 055 研究。基于独立数据监测委员会 (IDMC) 审查意见,该试验不太可能达到总体生存期(OS)的主要终点。在这项研究中,没有发现新的安全信号。据悉,这是bintrafusp alfa今年失败的第4项II/III期临床。
5.罗氏拟开发治疗AD基因疗法。Shape Therapeutics宣布与罗氏达成研发合作和许可,将利用其RNA编辑技术平台RNAfix,以及AAVid技术平台,开发治疗阿尔茨海默病、帕金森病和罕见疾病的“一次性治愈”基因疗法。RNAfix技术平台利用引入的指导RNA(guide RNA)便可在RNA水平上对基因突变进行编辑。RNAskip技术平台设计的独特tRNA,能够识别RNA序列上过早出现的终止密码子,让转译过程能够通读而生成正常的蛋白。此项合作Shape公司将获得超过30亿美元的前期和里程碑付款。
6.Vertex与Arbor达成12亿美元新合作。Vertex公司宣布与张锋博士联合创建的Arbor公司达成一项新合作。在2018年合作基础上,将利用Arbor专有的CRISPR基因编辑技术,以开发完全分化的、产生胰岛素的低免疫胰岛细胞,用于1型糖尿病的治疗;以及开发创新细胞疗法用于治疗镰刀型细胞贫血病(sickle cell disease)和β地中海贫血(beta thalassemia)等疾病。根据协议,Arbor将获得预付款,可能高达12亿美元的潜在里程碑付款。
医药热点
1.法国拟扩大第三剂疫苗接种范围。当地时间24日,法国新冠肺炎累计确诊病例接近665万例。法国卫生监管部门当天推出第三剂新冠疫苗接种意见,建议扩大有资格进行第三剂疫苗接种的人群适用范围。卫生监管部门认为,完成接种两剂新冠疫苗6个月后的人员可接种第三剂疫苗。按照法国官方此前计划,9月将开始为高危人群接种第三剂疫苗。
2.广东村村要设公卫委员会。广东省卫健委等部门联合出台《关于全面推进村(居)民委员会公共卫生委员会建设的通知》,提出至今年年底,各村(居)民委员会均设立公共卫生委员会,协助乡镇政府(街道办事处)、专业部门和机构,在重大疫情防控中协调配合做好人员摸排等工作;做好辖区内公共卫生工作的协调组织和动员;组织发动群众,开展爱国卫生运动,维护公共环境卫生等。
3.中国多款新冠疫苗不被认可。美国时间8月20日,美国约翰·霍普金斯大学宣布,学校只认可由FDA批准的新冠疫苗,包括Morderna、辉瑞和强生的三款疫苗。针对无法接种上述三种疫苗的国际学生,该大学将提供免费疫苗接种机会。按照该大学的要求,包括中国国药集团、科兴的两款国产疫苗在内,多款新冠疫苗不被认可。学校方面对此的解释是:FDA批准的几款疫苗对德尔塔变种有较高的防护效性。
评审动态
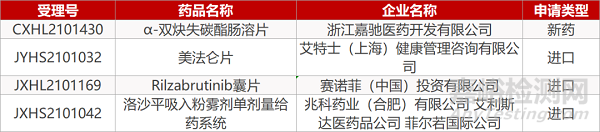
申请临床:
浙江嘉驰医药的α-双炔失碳酯肠溶片、赛诺菲的Rilzabrutinib囊片。
申请生产:
艾特士(上海)的美法仑片、兆科药业/艾利斯达医药的洛沙平吸入粉雾剂单剂量给药系统。

来源:药研发


