您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-11-24 11:33
摘 要
在当前我国药品监管机构信号检测工作的基础上,本文利用真实世界数据以及数据挖掘技术,探索构建一种可以及时发现、准确识别严重药品不良反应的循证证据新模式。该模式基于自发呈报系统数据库和医疗电子病历系统数据库,将药品不良反应信号检测分为信号初步发现、信号筛选、信号验证与信号评价四个环节,通过数据挖掘技术快速高通量地挖掘药品不良反应信号,逐步提升信号的证据等级,提高信号检测效率。与此同时,本文使用该模式进行了胆木制剂不良反应信号数据挖掘的实证研究,初步验证了该模式的可操作性,为药品监管部门顺利开展严重药品不良反应信号数据挖掘工作提供了范式经验。
Based on the current signal detection work of Chinese drug regulatory agencies, this paper explores the construction of a new evidence-based model for the timely detection and accurate identification of severe adverse drug reactions (ADRs) utilizing real-world data (RWD) and data mining techniques. This model, based on the spontaneous reporting system database and the electronic medical records system database, divides ADR signal data mining into four stages: initial signal detection, signal screening, signal verification, and signal evaluation. By applying data mining techniques, the model allows for rapid, highthroughput mining of ADR signals, which gradually improves the level of evidence of the signals and improves the efficiency of signal detection.In this paper, an empirical study using this model for the data mining of adverse reactions of Nauclea officinalis Pierre ex Pitard preparations is presented, initially verifying the model's operability and providing a paradigmatic experience for regulatory authorities to carry out data mining on severe ADR signals.
关键词
真实世界数据;严重药品不良反应;数据挖掘;信号检测;循证证据
real-world data; serious adverse drug reaction; data mining; signal detection; evidence-based evidence
根据世界卫生组织(World Health Organization,WHO)统计, 全球住院患者中约有10%~20% 的患者会发生药品不良反应,其中5% 的患者可因严重药品不良反应死亡[1]。我国每年因药品不良反应住院的患者至少有250 万人,其中有严重药品不良反应患者高达50 万人,约有19 万人因药品不良反应而死亡[2]。由于临床试验的受试者人数通常有限,一些罕见或长期用药才会出现的不良反应可能在试验阶段未能被充分发现,而药品上市后的真实世界使用是评估药品安全性和发现不良反应的重要阶段[3]。WHO 将信号定义为未知的或是尚未完全证明的药品与不良反应相关的信息[4]。如何及时发现、准确识别严重药品不良反应,实现不良反应早发现、早处置,已成为世界各国及地区药品监管机构亟需解决的重大民生问题之一。
真实世界数据包含了在真实世界环境下患者的用药信息记录,是挖掘药品不良反应信号的重要来源[5]。药品不良反应信号数据挖掘是在一个或多个来源的真实世界数据库中,通过比值失衡分析法等统计学方法,研究药品与疑似药品不良反应之间关联性的一种技术[6]。目前我国药品监管机构已使用自发呈报系统数据库,通过比值失衡分析法的数据挖掘技术来识别潜在的不良反应信号,然而该方式依赖上报者报告的不良事件,数据挖掘结果假阳性率较高,且其证据等级不足以支撑药品和不良反应间关联性的确认[7]。因此本文在当前数据挖掘工作的基础上,基于海南省药物警戒中心的实践案例,试图构建一套基于真实世界数据的严重药品不良反应信号数据挖掘的循证模式,以期在监管资源有限的情况下,达到利用真实世界数据进行低成本、高效率挖掘非预期严重药品不良反应的目的。
1、 基于真实世界数据的严重药品不良反应信号数据挖掘模式概述
真实世界数据是指从自发呈报系统数据、医疗电子病历系统数据、医疗保险索赔数据等各种来源收集的与患者健康状况和(或)医疗服务相关的数据[3]。本文所构建的严重药品不良反应信号数据挖掘的循证模式,使用了自发呈报系统数据和医疗电子病历系统数据这两类真实世界数据。首先是信号初步发现环节,基于国家药品不良反应监测系统的自发呈报系统数据,利用比值失衡分析法,初步检测潜在的药品不良反应信号;该步骤可实现对药品的快速高通量风险分析,及时发现潜在的不良反应信号。其次是信号筛选环节,经过与药品说明书上的已知不良反应对比,在上述潜在的药品不良反应信号中筛选非预期且需要药物治疗的不良反应信号;该步骤的目的是瞄准容易造成社会影响的新的严重药品不良反应。再次是信号验证环节,基于医疗电子病历系统数据库采用处方序列对称分析法(prescription sequence symmetry analysis,PSSA)开展信号验证研究,进一步论证药品与疑似药品不良反应间的关联性;该步骤不依赖上报者报告数据,能有效提高数据挖掘结果的循证等级。最后是信号评价环节,结合文献研究与专家研讨等方式进行信号评价,确定药品与疑似药品不良反应间的关联性,具体流程如图1 所示。
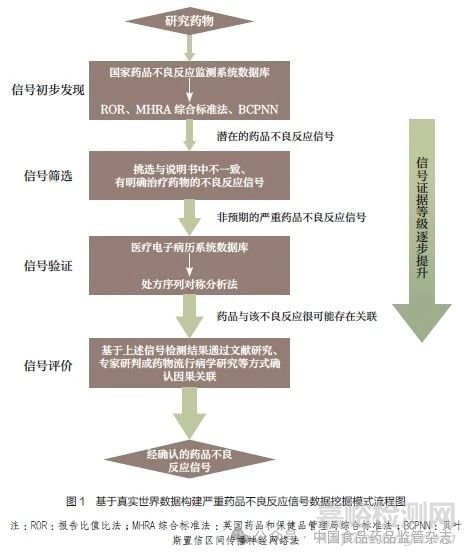
2、 基于真实世界数据的严重药品不良反应信号数据挖掘模式的优势分析
2.1 对药品进行快速高通量的风险分析,及时发现潜在不良反应信号
国家药品不良反应监测系统是全球范围内覆盖人口最广、体量最大的自发呈报系统数据库之一, 是目前药品上市后不良反应信号的重要数据来源。基于报告比值比法(reporting odds ratio,ROR)、英国药品和保健品管理局(Medicines and Health care Products Regulatory Agency, MHRA)综合标准法、贝叶斯置信区间传播神经网络法(Bayesian confidence propagatio nneural network,BCPNN) 的数据挖掘技术仅需提取该药物的不良反应报告,即可通过计算实现不良反应信号的自动化识别,是挖掘药品安全性问题最有效、最具经济性的手段之一[8]。基于该步骤可对药品进行快速高通量的信号识别,及时发现潜在的药品不良反应。当然,由于该数据库依赖上报者报告的不良事件,信号结果假阳性率较高,因此仅作为药品不良反应信号识别的第一步,产生药品不良反应信号源,其结果仍需进一步研究进行验证[9]。
2.2 不依赖上报者数据,提升数据挖掘结果的循证证据等级
基于第一步发现的潜在不良反应信号,将继续通过医疗电子病历系统数据库使用PSSA 进行信号验证。与自发呈报系统数据相比,医疗电子病历系统数据自动记录了患者的诊疗过程,数据库信息完整性好,对临床日常实践具有良好的代表性[5]。同时PSSA 无需识别药物不良反应报告,仅需要少数变量即可进行数据挖掘,具有快速、准确、低成本的优点,极大地弥补了传统信号检测工作假阳性率高的短板[10]。通过自发呈报系统数据库实现快速高通量地发现潜在不良反应信号,再通过医疗电子病历系统数据使用PSSA 开展快速的信号验证,通过线索的相互印证提升药品不良反应信号数据挖掘的证据等级,有效提升数据挖掘结果的准确性。
2.3 关注需要药物治疗的不良反应信号,优化药品监管资源配置
药品不良反应会对人体造成不同程度的损害,有些不良反应较轻微,不需要特殊处理即可消失,但对公众造成严重伤害的、需要进一步采用药物治疗的药品不良反应须引起社会关注。在监管资源有限的情况下,将基于自发呈报系统发现的所有不良反应信号都进行验证是不切实际的,因此必须对信号进行分类处理。临床症状较轻微且能够自行恢复的药品不良反应,不会造成严重的后果;而严重药品不良反应通常有明确的药物治疗措施(例如肝脏损伤需应用特定的保肝药进行治疗),如果不采取措施,可能会致残、致命,甚至对社会造成危害。优先选择有明确药物治疗措施的严重药品不良反应进行下一步信号验证,将精力集中在最关键、最紧急的药物安全性问题上,更加符合当前监管工作需求[11]。本文构建的新模式仅识别严重不良反应信号并进行验证,有利于优化药品监管资源配置。
3、 具体实施步骤解析
3.1 信号初步发现环节
提取国家药品不良反应监测中心的自发呈报系统数据,将待监测药物作为研究对象,利用比值失衡分析法对药物的不良反应报告开展计算机辅助信号检测,识别潜在不良反应信号。基于自发呈报系统数据库,使用ROR、MHRA 综合标准法、BCPNN 进行数据挖掘,获取待研究药物的潜在不良反应信号。
3.1.1 自发呈报系统数据来源
提取国家药品不良反应监测中心中目标药品的自发呈报系统数据,获取目标药品的所有疑似药品不良反应报告,并进行数据清洗与转化。数据清洗包括:①去除数据库原始数据中的重复记录报告。②对于如药品通用名称、不良事件名称等重要信息缺失的报告进行规整。③将同一病患同时出现的不同不良事件(即疑似药品不良反应)进行拆分。数据转化是指数据标准化,主要包括药品通用名称标准化与不良反应术语标准化。本文基于《监管活动医学词典》(Medical Dictionary for Regulatory Activities ,MedDRA) 27.0 版对不良反应术语以首选语(preferred term,PT)层级进行标准化,以便于开展信号检测分析。
3.1.2 基于比值失衡分析法初步识别信号
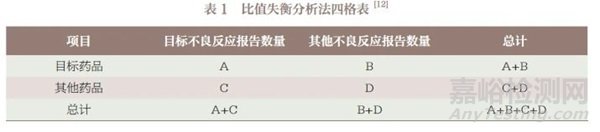
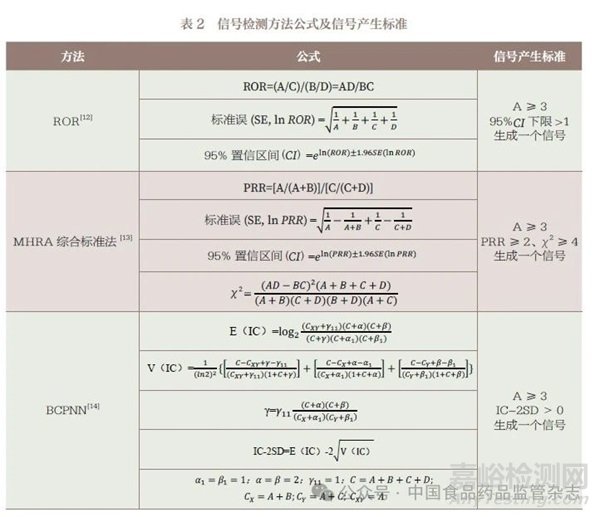
采用ROR、MHRA 综合标准法、BCPNN 三种信号检测方法开展计算机辅助信号检测。基于构建的比值失衡分析法四格表( 表1), 根据公式分别计算ROR、卡方值(χ 2)及IC 值等信号判断指标(表2)。为减少假阳性率,将3 种方法中同时检测到的该药品不良反应阳性结果记为潜在的药品不良反应信号,即同时满足ROR 法中95%CI 下限> 1 且报告数≥ 3 例的事件,MHRA 综合标准法中PRR ≥ 2、χ 2 ≥ 4 且报告数≥ 3 例的事件,BCPNN 法中IC-2SD>0 且报告数≥ 3 例的事件定义为潜在药品不良反应信号,统计分析使用Python 3.8 软件。
3.2 信号筛选环节
基于自发呈报系统的数据挖掘关注的是报告数量在统计学上的关联,其结果存有大量假阳性信号。该部分基于上一步挖掘出的信号进行信号筛选,从与说明书现有不良反应项内容是否存在区别、是否为有明确治疗药物两方面筛选值得关注的严重不良反应信号。
具体操作步骤如下。首先,将上述药品不良反应信号与现有说明书进行对比,进行信号分类。①一致描述:药品不良反应信号术语是说明书中已存在的不良反应,不进行后续分析。②同类警示:说明书相关不良反应术语与信号术语意义相近,可能存在父集(概括)或子集(包含)关系或者疾病术语存在不同程度分级,但说明书未详细描述,该类信号需结合说明书描述进行针对性分析。③完全无描述:药品不良反应信号术语是该药品新发现的风险,这类信号需要进一步验证评估。其次,在同类警示和完全无描述的不良反应中挑选明确需要药物治疗的不良反应作为潜在的严重不良反应信号进行下一步信号验证。
3.3 信号验证环节
基于上述步骤发现的潜在药品不良反应信号,使用PSSA 进行信号验证。PSSA 的基本思路是使用某种药品的处方(标签药)来代替某特定药品(指示药)引起的不良反应,再基于指示药与标签药的处方时序分布的对称性来挖掘不良反应信号。即提取医疗电子病历系统数据中同时开具过标签药与指示药处方的患者信息,对纳入的研究对象依据两种药物处方的先后次序对患者进行分组,通过指示药与标签药的处方时序对称分布来验证该药品不良反应信号。
3.3.1 医疗电子病历系统数据来源
基于上一步产生的潜在药品不良反应信号,选取治疗该药品不良反应的药物作为标签药,研究药物作为指示药,PSSA 的具体流程如图2 所示[15]。提取单家或多家医疗电子病历系统数据中同时开具过指示药和标签药处方的患者数据,包括患者编码、用药名称及用药时间等变量,以患者编码为关联索引,将不同医疗机构的患者数据进行串联,对用药信息、用药时间进行标准化以便于统计分析。

3.3.2 基于PSSA 进行信号验证
(1)间隔期和洗脱期的选择。间隔期是指示药处方日期与标签药处方日期之间的间隔时长,是预期不良反应发生的合理时间区间,指示药与标签药处方时间超过间隔期的患者被排除。洗脱期是为了确定首次用药者,设置的没有指示药或标签药处方的时长,符合该时长内无相应药物处方者被视为首次用药者。洗脱期可以通过waiting time 分步法,亦可参考既往研究进行确定。
(2)计算序列比。在同时使用标签药和指示药的患者中排除不符合间隔期和洗脱期的患者,对纳入的研究对象依据2 种药物处方的先后次序对患者进行分组并确定每组样本量,其中“causal(先因后果)” 组是患者先处方了指示药物A,然后处方了标签药物B ;相反“non-causal( 非先因后果)” 组是先处方了标签药物B,然后再处方了指示药物A。计算粗略的序列比(crude sequence ratio,CSR), 公式如下:

通过计算空效应序列比(null effect sequence ratio,NESR)来调整由于处方随时间变化的自然趋势所带来的偏移,该指标反映了研究周期内处方频率的变化趋势。计算方法为:如果在第m天服用了药品A,那么A → B 次序的可能性P 值计算公式为:
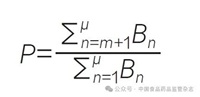
式中,μ 是调查期的最后一天,B 是特定某一天首次服用了药品B 的人数,P 是所有时间内处方顺序是A → B 的可能性。分子部分是所有在第m 天之后服用药品B 的患者人数,分母是研究期内所有首次服用药品B 患者的总人数。全部A → B 的概率为α,当所有观察时间内都是以P 为概率的时候,以每天服用药品B 的患者对上式进行加权:
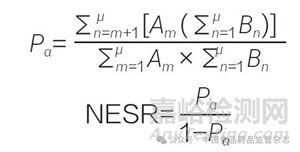
用CSR/NESR 得到调整序列比(adjusted sequence ratio ,ASR), 当ASR 的95%CI 下限大于1 时,说明药物A 与不良反应可能存在因果关联:ASR = CSR/NESR
3.4 信号评价环节
信号检测只是作为前期的一种可疑信号发现,指明药品与不良反应之间是否存在关联及关联强度,并不代表药品与不良反应之间存在必然的因果联系,因此仍需进一步专家评估,必要时还需采用药物流行病学调查、因果判别准则等评价方法加以确定。
具体而言,若基于PSSA 的信号验证结果为阳性,则代表该药品与疑似药品不良反应很可能存在关联;反之,则代表该药品与疑似药品不良反应很可能不存在关联。此时仍需要针对该药品不良反应信号进行文献研究,通过病例报告审阅的方式收集原始资料,召开专家进行信号评判,必要时还需要进行药物流行病学研究等更高证据等级的方法进行最终的信号确认。
4、基于胆木制剂的实证研究
为了验证上述思路的可行性,海南省药物警戒中心与中国药科大学联合进行了基于胆木制剂的实证研究,以探索该模式的可行性。
4.1 研究思路
本研究所述胆木制剂是指胆木相关的中药制剂,具体包括胆木浸膏糖浆、胆木注射液、胆木浸膏片和胆木浸膏胶囊。以胆木制剂作为目标研究药物,使用本文构建的数据挖掘模式进行实例探索。基于胆木制剂上市后自发呈报系统数据库展开计算机辅助信号检测,通过比值失衡分析法识别不良反应信号;利用医疗电子病历系统数据对非预期的不良反应信号使用PSSA 开展数据挖掘,以初步验证不良反应与胆木制剂之间的因果关联性。
4.2 具体实现过程
4.2.1 挖掘潜在的不良反应信号
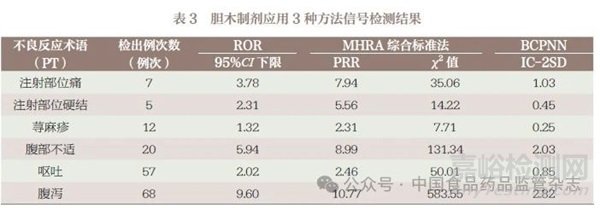
收集国家药品不良反应监测中心与海南省药物警戒中心在2004 年1 月1 日至2023 年6月30 日的不良反应报告,以通用名“胆木浸膏糖浆”“胆木注射液”“胆木浸膏片”“胆木浸膏胶囊”以及商品名“森震”“木严青”“森博”“珍木青”为目标药物名称进行检索,进行数据清洗、去重处理后,共得到胆木制剂相关的不良反应报告353 例,其中胆木制剂作为怀疑用药的报告共343 例,据此构建综合性上市后监测数据库。使用3 种方法共同检出的信号有6 个,分别是注射部位痛、注射部位硬结、荨麻疹、腹部不适、呕吐、腹泻,信号检测结果见表3。
4.2.2 筛选非预期的严重药品不良反应信号
通过比较信号与说明书现有不良反应是否存在区别以及是否有明确的治疗药物,排除注射部位痛、注射部位硬结、腹部不适、呕吐、腹泻这些信号,选择荨麻疹作为值得关注的信号进行下一步的信号验证。
4.2.3 进行循证证据等级提升
基于《中国荨麻疹诊疗指南(2022 版)》,将第二代非镇静性的抗组胺药作为治疗荨麻疹的药物,即本研究中的标签药,胆木制剂为指示药。提取海南医学院第一附属医院、海南医学院第二附属医院、海口市人民医院共3家医院的医疗电子病历系统数据,将在2011~2023 年期间收治的15 783 例同时处方过标签药与指示药的患者数据作为原始数据。
(1)确定间隔期和洗脱期。本研究中,胆木制剂产生荨麻疹疑似不良反应的时间为60 天以内,因此本研究将间隔期设置为60 天。根据既往研究中所设置的洗脱期,将洗脱期设置为30 天,以纳入首次用药者。最终纳入用药时间符合间隔期和洗脱期要求的患者共5277 例。
(2)据药物使用次序的先后进行分组,并确定两组的患者人数。其中,先使用胆木制剂后使用荨麻疹治疗药物的患者共2722例,先使用荨麻疹治疗药物后使用胆木制剂的患者共2555 例,据此可计算两组之间的比值,即CSR 为1.0654。
(3)根据Pα 的计算公式,计算得出整个研究期间内处方顺序为胆木制剂→荨麻疹治疗药物的概率Pα, 结果Pα值为0.4980,NESR 值为0.9921。
(4) 根据公式计算得出本研究胆木制剂- 荨麻疹的ASR为1.0739 (95%CI:1.0604~1.0874), 即95%CI 下限>1,表明胆木制剂与荨麻疹之间可能存在因果关联。

4.2.4 通过信号评价确认因果关联
针对胆木制剂进行文献研究,检索中国知网、PubMed 等文献数据库,综述胆木制剂的安全性信号,暂无对使用胆木制剂产生荨麻疹的不良反应报道。然而荨麻疹属于过敏反应,有文献表明[16],中药制剂多为复方并且成分比较复杂,易引发过敏的因素比较多,比如中药注射剂中可能含有鞣质、淀粉、蛋白质等大分子有机物,这些物质进入人体后,在一些特殊条件下,可以诱发热原反应和过敏反应,此外患者个体差异或者使用不当等因素都会导致过敏反应的发生。基于上述信号检测结果和文献研究的证据分析,胆木制剂与荨麻疹很可能存在关联,需要进一步的药物流行病学研究进行确认。
5、 总结
建立快速有效的数据挖掘模式可以为药品风险识别及评价提供有价值的信号, 有助于及时、快速、准确地发现严重的药品不良反应, 减少其造成的伤害。本文在当前我国药品不良反应信号数据挖掘工作模式的基础上,聚焦于严重药品不良反应信号,利用医疗电子病历系统数据的PSSA 开展信号验证研究,提升信号证据等级,快速高效地挖掘药品不良反应信号,为药品监管部门开展信号检测工作提供了一套新的理论范式。此外,本研究还将该模式应用于胆木制剂上市后的安全性监测中,通过基于自发呈报系统的比值失衡分析法与基于医疗电子病历数据库的PSSA 同时发现了荨麻疹这个不良反应信号,证明胆木制剂与荨麻疹很可能存在关联,在临床用药过程中需要关注该不良反应的发生。
引用本文
黄凌,苗会青,苏小洁,杨婧斐,贺梦娇,柳鹏程,林凯,宋海波*.基于真实世界数据构建严重药品不良反应信号数据挖掘模式——以胆木制剂为例进行实证[J].中国食品药品监管.2024.10(249):102-111.

来源:中国食品药品监管杂志


