您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-10-29 14:36
美国食品药品监督管理局(FDA)在2021年8月1日发布了联邦公报(83 FR36598)公布了2022财政年度(2021年10月1日至2022年9月30日)医疗器械收费标准。其中年度企业注册和器械列名费用由2021财年的5546美金,上涨到2022财年的5672美金,涨幅约2.3%。510(K)的申请费用也有2.5%的增长。需要年度更新的企业在2021年10月1日到2021年12月31日期间进行年度续费即可。
FDA在医疗器械上市批准申报过程中依然保留小规模企业优惠政策,以减轻企业申报FDA在医疗器械上市批准申报的负担。小规模企业优惠比例见下表:
|
申请类型 |
2022财年 |
|
|
标准收费 |
小规模企业收费 |
|
|
510(k)申请 |
$12,745 |
$3,186 |
|
企业注册年费 |
$5,672 |
$5,672 |
温馨提示:
1)每年10月1日到12月31日期间,需要更新FDA注册以确保下一年持续处于有效状态;
2)510(K)的小企业资质申请结果,不能跨越财政年度使用。请基于510(K)申报进度计划合理安排申报小企业资质的时间。
其他收费情况如下:
|
Medical Device Fees for FY 2022 |
||
|
Application fee type |
standard fee($) |
small business fee($) |
|
PMA、PDP、PMR、BLA |
374,858 |
93,714 |
|
Panel-track supplement |
281,143 |
70,286 |
|
De novo classification request |
112,457 |
28,114 |
|
180-day supplement |
56,229 |
14,057 |
|
Real-time supplement |
26,240 |
6,560 |
|
510(k) |
12,745 |
3,186 |
|
30-day notice |
5,998 |
2,999 |
|
513(g) |
5,061 |
2,530 |
|
Annual Fee for Periodic Reporting on a Class III device(PMAs, PDPs, and PMRs) |
13,120 |
3,280 |
|
Annual establishment registration fee |
5,672 |
5,672 |
附:FDA小规模企业申请指南
一、申报条件:
企业上一年度的总收入/销售额不超过1亿美元(包含分公司的收入/销售额),不限于美国企业,包含向FDA申报医疗器械列名或注册的所有国别的生产企业。
分公司定义:与另一家公司有关联的公司实体,直接或间接地
1)由另一家公司实体控制或其有权利控制此公司实体;
2)两家公司实体被第三方控制或第三方有权利控制这两家公司实体;
二、申报费用:可减免
三、FDA审核周期:
FDA收到资料受理后,会在60天内对文件做审查并给出回复,如果被认定为小企业,FDA会向企业发送“小企业决定号”。
四、申报须知:
2022年小规模企业资质的最早申请时间:2021-8-1;最晚申请时间:2022-9-30;
小企业资质有效期为美国当年财政年。2021年小企业资质于2021-9-30到期;
2021-9-30后,如果希望继续保留小企业资质,须申请2022年资质
五、申报难点:
1、需要企业所在地的税务局在资质申报表格的英文件上盖章,若不能拿到税务局盖红章的英文表格,将无法成功申请到小企业资质。
2、按照以上申报标准,多数中国医疗器械生产企业都符合FDA的小企业资质条件,医疗器械生产企业可以充分利用此优惠机会,节省相关注册费用。
医疗器械在美国是如何被监管的?
美国FDA是国际医疗审核权威机构,由联邦政府授权,专门从事食品和药品管理的最高执法机关。
它是联邦政府在健康与人类服务部(United States Department of Health and Human Service;DHHS)下属的公共卫生部(PHS)中设立的执行机构之一。
医疗器械、食品、化妆品、药品需要进行FDA注册。
医疗器械具有怎样的法规体系?
FDA主管食品、药品(包括兽药)、医疗器械、食品添加剂、化妆品、动物食品及药品、酒精含量低于7%的葡萄酒饮料以及电子产品的监督检验;产品在使用或消费过程中产生的离子、非离子辐射影响人类健康和安全项目的测试、检验和出证。
根据规定,上述产品必须经过FDA检验证明安全后,方可在市场上销售。
FDA有权对生产厂家进行视察、有权对违法者提出起诉。
FDA组成部门包括食品安全和实用营养中心(CFSAN)、药品评估和研究中心(CDER)、设备安全和放射线保护健康中心(CDRH)、生物制品评估和研究中心(CBER)、兽用药品中心(CVM)。
除血源筛查的医疗器械由生物制品评估和研究中心(CBER)负责管理外,其余的医疗器械均由器械和放射产品健康中心(Center for Devices and Radiological Health ;CDRH)负责管理。
CDRH的职能有哪些?
其中CDRH就相当于医疗器械管理司。主要负责以下工作:
对科研或者临床用途的医疗器械申请进行审核;
收集、分析并处理医疗器械和放射性电子产品在使用过程中有关信息;
为放射性电子产品和医疗器械建立良好的生产实践规范以及性能标准,并组织实施。
CDRH底下有7个办公部门负责相关业务,包括交流教育办公室(Officeof Communication and Education)、符合性办公室(Office of Compliance)、管理办公室(Office of Management)、科学工程实验室办公室(Office of Scienceand Engineering Laboratories)、器械评价办公室(Office of Device Evaluation)、体外诊断试剂和放射安全办公室(Office of In Vitro Diagnostics and Radiological Health)、生物统计和监督办公室(Office of Surveillance and Biometrics)。
因此,体外诊断试剂的管理有其专门的办公室。
美国联邦食品药品和化妆品法令CFR
美国联邦食品药品和化妆品法令是美国联邦法典(Code of Federal Regulations;CFR)第九章,通常称为21(title 21)。
CFR是美国联邦政府执行机构和部门在联邦公报中发表与公布的一般性和永久性规则的集成,具有普遍适用性和法律效应。
CFR的编纂工作始于1936年,最初,联邦政府公报室将联邦政府机构当天发布的所有行政法规、会议纪要、决定、通知以及将要议定的行政法规草案等编辑成联邦政府公报手册(相当于联邦行政法律全书),对外公布,周一至周五每周共五册,每年200多册。
后来,由于行政法律全书数量越来越多,内容庞杂,查询起来极为困难。
因此,1936年联邦政府参照美国法典的编纂方式开始进行行政法典的编纂。
CFR的构成
CFR共50篇(title),部分有章(subtitle),分别代表联邦法规的各个领域;
每篇中有若干部分(part),各部分通常以法规颁发机构的名称为标题,例如Title 35的part I 为美国专利与商标局(United States Patent andTrademark Office);
每个部分分为若干章(chapter),每章分为若干节(section)。
CFR 21是对食品、药品、医疗器械的规定,共9卷,由1-99部分、100-169部分、170-199部分、200-299部分、300-499部分、500-599部分、600-799部分、800-1299部分及1300至结束组成。第8卷的800-1299部分为医疗器械的法令。公众可以在FDA官网上查询相应的FDA的法规。
例如,我们听过最多的可能就是21CFR 820,它是现行的FDA生产质量管理规范。
FDA医疗器械分类方法详解
美国FDA医疗器械产品目录中共有1700多种。根据风险等级的不同,FDA将医疗器械分为三类(Ⅰ,Ⅱ,Ⅲ)。风险等级逐级升高,Ⅲ类风险等级最高。FDA对每一种医疗器械都明确规定了其产品分类和管理要求。
首先,对于任何产品,企业都需进行企业注册与产品列名(Enterprise Registration and Product Listing)。
I 类器械
一般控制(General Control)
绝大部分产品只需进行注册、列名和实施GMP规范,产品即可进入美国市场(其中极少数产品连GMP也豁免,极少数保留产品则需向FDA递交510(K)申请即PMN(Premarket Notification))
这些器材只要经过一般控制就可以确保其功效与安全性,如拐杖、眼镜片、胶布等,约占全部医疗器材的27%。
这些控制包括:
禁止粗制滥造及不当标示的产品销售;
FDA得禁止不合格产品销售;
必须报告FDA有关危害性、修理、置换等事项;
限制某些器材的贩卖、销售、及使用;
实施GMP(Good Manufacturing Practice)。
Ⅱ类产品(占46%左右)
一般控制 + 特殊控制(Special Control)
企业在进行注册和列名后,这些产品除了上述一般控制之外,其余大多数产品均要求进行上市前通告(PMN:Premarket Notification)(即510K)。少量的II类产品可以豁免上市前通告程序。生产企业须在产品上市前90天向FDA提出申请,通过510K审查后,产品才能够上市销售。
Ⅲ类产品(占7%左右)
一般控制 + 上市前许可(Premarket Approval)
企业在进行注册和列名后,须实施GMP并向FDA递交PMA申请(部分Ⅲ类产品还是PMN)。
一般来说, III类产品多为维持、支持生命或植入体内的器材,对病患具有潜在危险,可能引起伤害或疾病者,如心律调节器、子宫内器材及婴儿保温箱等,约占所有器材的8%。这些器材必须取得FDA的PMA之后方能销售。
对Ⅰ类产品,企业向FDA递交相关资料后,FDA只进行公告,并无相关证件发给企业;
对Ⅱ、Ⅲ类器械,企业须递交PMN或PMA,FDA在公告的同时,会给企业以正式的市场准入批准函件(Clearance),即允许企业以自己的名义在美国医疗器械市场上直接销售其产品。
至于申请过程中是否到企业进行现场GMP考核,则由FDA根据产品风险等级、管理要求和市场反馈等综合因素决定。
综合以上内容可知,绝大部分产品在进行企业注册、产品列名和实施GMP,或再递交510(K)申请后,即可获得FDA批准上市。
除了依据器材的风险来分级之外,依照器材的用途,FDA把现有医疗器材产品总共被分成16类(medical specialty "panels")。
|
Medical Specialty |
Regulation Citation (21CFR) |
|
|
73 |
Anesthesiology |
Part 868 |
|
74 |
Cardiovascular |
Part 870 |
|
75 |
Chemistry |
Part 862 |
|
76 |
Dental |
Part 872 |
|
77 |
Ear, Nose, and Throat |
Part 874 |
|
78 |
Gastroenterology and Urology |
Part 876 |
|
79 |
General and Plastic Surgery |
Part 878 |
|
80 |
General Hospital |
Part 880 |
|
81 |
Hematology |
Part 864 |
|
82 |
Immunology |
Part 866 |
|
83 |
Microbiology |
Part 866 |
|
84 |
Neurology |
Part 882 |
|
85 |
Obstetrical and Gynecological |
Part 884 |
|
86 |
Ophthalmic |
Part 886 |
|
87 |
Orthopedic |
Part 888 |
|
88 |
Pathology |
Part 864 |
|
89 |
Physical Medicine |
Part 890 |
|
90 |
Radiology |
Part 892 |
|
91 |
Toxicology |
Part 862 |
当然,这只是一个大致的分类。具体到某一个器械,属于哪一类,以及是否得到豁免,均需通过查找其相对应的法规编号。1700类产品,每一类产品都有一个法规编号与之对应。
那么,如何查找法规编号?
方法一:进入FDA官网中的classification database页面(http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpcd/classification.cfm)。您就会看到下方的页面:有两种方法。

如果您知道器械的部分名称,您就可以找到相对应的法规编号。
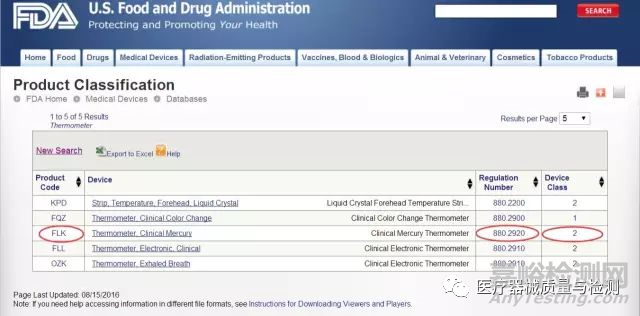
比如:要找 Clinical Mercury Thermometer这个产品的法规编号,就把Thermometer输进红框中,接着就可以看到下面这个页面。在这里,不仅能够看到法规编号,还可以看到产品代码和器械分类级别。
方法二:如果知晓该器械属于之前所提及的16类中的某一类,就可以进入FDA官网的Device Classification Panels(http://www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/Overview/ClassifyYourDevice/ucm051530.htm)页面搜索。

来源:Internet


