您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-16 14:08
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
科济CAR-T在欧洲获优先药物资格。科济药业靶向Claudin18.2(CLDN18.2)的自体CAR-T疗法CT041获欧洲药品管理局(EMA)授予优先药物(PRIME)资格,用于治疗胃癌/胃食管结合部癌。在一项Ⅰ期临床中,CT041在既往至少2线治疗失败的胃癌患者中达到61.1%(11/18)的客观缓解率,中位PFS为5.4个月,中位OS为9.5个月。此前,FDA和EMA已先后授予CT041用于治疗胃癌的孤儿药资格。这也是科济药业第二个CAR-T产品获得PRIME认定。
国内药讯
1.甘莱FXR激动剂获批II期临床。歌礼旗下甘莱制药非甾类FXR激动剂ASC42治疗原发性胆汁性胆管炎(PBC)的II/III期临床试验申请获得国家药监局默示许可。ASC42已在美国开展的I期临床中取得良好的安全性和药效学生物标志物顶线数据。甘莱计划在完成中国II期临床后,在美国和欧盟启动其III期临床试验。目前,ASC42还在临床研究中用于治疗慢性乙型肝炎(CHB)和非酒精性脂肪性肝炎(NASH)。
2.信达VEGF靶点眼科品种早期临床积极。信达生物“first-in-class”VEGF/补体双靶点融合蛋白IBI302治疗新生血管性年龄相关性黄斑变性(nAMD)的Ib期临床结果积极。数据显示,IBI302组受试者中最佳矫正视力较基线提平均提高6.4个字母,平均中央区视网膜厚度较基线减少129.3微米。临床中,未报告剂量限制性毒性,未发生与研究药物相关的不良事件及严重不良事件。详细结果将在2021年美国眼科年会上公布。
3.诺诚健华ICP-189获FDA临床许可。诺诚健华新型SHP2变构抑制剂ICP-189获FDA批准,将在美国开展一项开放性、单臂、多中心研究,评价ICP-189单药以及联合用药治疗晚期实体瘤患者的安全性、耐受性、药代动力学特征和有效性。SHP2是一种非受体蛋白酪氨酸磷酸酶,在MAPK信号通路和免疫检查点通路中发挥作用,可调节细胞增殖和存活。ICP-189也是该公司第四款在美国获批临床的创新药。
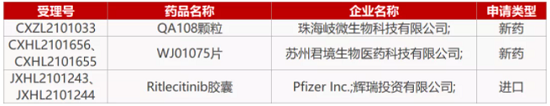
4.君境生物XPO1抑制剂报IND。君实生物与微境生物的合资公司君境生物申报的XOP1抑制剂WJ01075的临床试验申请获CDE受理。2020年9月,君实生物引进微境生物4款小分子新药50%权益,目前4款小分子新药中已有3款申报临床。WJ01075也是国内第2款申报临床的XPO1抑制剂。此前,德琪医药引进品种Selinexor已获批进行多项临床研究,包括单药治疗以及联合治疗。
5.捷思英达完成新一轮融资。捷思英达宣布完成B轮融资。本轮由泰格医药、百度风投共同领投,前海贝增、久友资本跟投,老股东聚明创投和倚锋资本继续加码,BFC担任独家财务顾问。本轮融资将主要用于推进该公司两个核心产品(JSI-1187和VIC-1911)的临床开发。JSI-1187是一款口服ERK1/2激酶抑制剂;VIC-1911是一款具有“first-in-class”潜力的新一代Aurora A激酶抑制剂。
国际药讯
1.FDA批准首款干扰素治疗PV。台湾生物制药公司药华医药的长效干扰素制剂Besremi(通用名ropeginterferon alfa-2b-njft)获FDA批准上市,用于成人真性红细胞增多症(PV)的治疗。在一项Ⅲ期临床PEGINVERA中,Besremi治疗组有80%患者达到血液学应答、61%患者达到完全应答,常见副作用包括感冒样症状、疲劳、瘙痒等。该产品此前已在欧盟获批上市。
2.欧盟支持Kaftrio联合ivacaftor方案扩大适用人群。欧洲药品管理局(EMA)人用医药产品委员会(CHMP)建议批准Vertex制药公司Kaftrio(ivacaftor/tezacaftor/elexacaftor)与ivacaftor联合用药方案标签扩展,用于治疗年龄在6-11岁、囊性纤维化跨膜电导调节子(CFTR)基因中存在至少一个F508del突变的囊性纤维化(CF)患者。在欧洲,这一联用方案此前已获批用于治疗年龄≥12岁、CFTR基因中存在至少一个F508del突变的CF患者。
3.C3抑制剂Empaveli新适应症将报NDA。Apellis Pharma公司宣布已收到FDA的书面回复,计划明年提交玻璃体腔注射Empaveli治疗年龄相关性黄斑变性(AMD)继发性地图样萎缩(GA)新药申请(NDA)。NDA将由Ⅲ期DERBY和OAKS研究以及Ⅱ期FILLY研究的疗效和安全性数据支持。Empaveli(pegcetacoplan)是一款靶向性C3抑制剂,已于今年5月获FDA批准上市,用于治疗阵发性睡眠性血红蛋白尿症(PNH)成人患者。
4.诺华/安进偏头痛药物IV期结果积极。诺华制药与安进联合开发的靶向CGRP的偏头痛药物Aimovig(erenumab)IV期研究HER-MES(NCT03828539)数据积极。与托吡酯相比,Aimovig在24周治疗期间因不良事件导致的停药率显著降低(10.6%vs38.9%);有更高比例的患者每月偏头痛天数(MMD)至少减少50%(55.4%vs31.2%);该研究中,Aimovig的安全性与先前临床研究中的一致。详细结果发布在《Cephalalgia》期刊上
5.艾伯维JAK1抑制剂Ⅲ期临床新数据积极。艾伯维口服JAK1抑制剂乌帕替尼(Rinvoq)治疗类风湿关节炎的Ⅲ期临床SELECT-BEYOND新数据积极。在Rinvoq联合csDMARD治疗组中,有34%患者在第60周前首次出现应答时实现了临床疾病活动指数缓解(CDAI≤2.8),79%的患者达到CDAI低疾病活动度(LDA;CDAI≤10);分别有39%和61%的患者在60周时观察到CDAI缓解和CDAI LDA;在接受Rinvoq治疗失去CDAI缓解的患者中,有58%仍保持CDAI LDA。
6.Shasqi公司完成B轮融资用于SQ3370临床。Shasqi公司宣布完成5000万美元的B轮融资,以用于推进其瘤内注射给药的抗癌药物SQ3370治疗晚期实体瘤的Ⅰ/Ⅱ期临床。SQ3370是一款基于点击化学(click chemistry)技术开发的、能在肿瘤部位激活化疗药物阿霉素的精准激活肿瘤疗法。Shasqi公司计划明年第1季度启动SQ3370用于治疗无法耐受化疗的软组织肉瘤患者的Ⅰ期临床扩展队列;2022年启动SQ3370的Ⅱ期注册性研究。
医药热点
1.17日起进京须持48小时核酸证明。由于国内多地出现多源输入、多点并发疫情,北京也出现京外关联本地聚集性疫情,北京疫情防控工作组日前调整了进出京管理政策。自2021年11月17日零时起,人员进(返)京须持48小时内核酸检测阴性证明和“北京健康宝”绿码,14日内有1例以上(含1例)本土新冠病毒感染者所在县(市、区、旗)旅居史人员将严格限制进(返)京。
2.国家基药目录管理办法出台。11月15日,国家卫健委发布《国家基本药物目录管理办法(修订草案)》并公开征求意见。《草案》明确,国家基药目录将定期评估、动态管理,调整周期原则上不超过3年。调整的品种和数量将考虑6方面因素:我国基本医疗服务需求和基本医保水平变化;我国疾病谱变化;药品不良反应监测评价;药品使用监测和临床综合评价;已上市药品循证医学、药物经济学评价;国家基药委员会规定的其他情况。
3.浙江发展普惠应急救护服务。浙江省印发《关于高水平推进应急救护工作的实施意见》提出,浙江省应急救护工作到2025年将实现4个目标:全省公众应急救护技能普及率累计达40%以上;全省新增应急救护持证人员200万名;公安、交通、应急救援等重点行业领域从业人员应急救护持证率不低于50%,公共场所自动体外除颤仪设置达每万人1.5台;开发建设一批集“120”急救指挥系统等。
评审动态

来源:药研发


