您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-03 10:11
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
百济神州IL-6抑制剂国内获批上市。百济神州引进新药注射用司妥昔单抗获国家药监局批准上市,用于人体免疫缺陷病毒(HIV)阴性和人疱疹病毒8型(HHV-8)阴性的多中心卡斯特曼病(MCD,Castleman病)成人患者。司妥昔单抗是该公司从EUSA Pharma引进的一款IL-6抑制剂,可用于直接中和在多种炎症中均能检测到升高的炎性细胞因子IL-6的活动。属于国内第一批临床急需境外新药。
国内药讯
1.西达本胺新适应症在日本获批。微芯生物与沪亚生物联合开发的西达本胺(HBI-8000)在日本获批新适应症,用于单药治疗复发性或难治性(R/R)外周T细胞淋巴瘤(PTCL)。西达本胺是一款新分子实体药物,是全球首个亚型选择性HDAC抑制剂和全球首个获批治疗外周T细胞淋巴瘤和联合内分泌药物治疗雌激素受体阳性乳腺癌患者的口服药物,属于表观遗传调控剂类药物。
2.再鼎「尼拉帕利」中国Ⅲ期临床积极。再鼎医药口服PARP抑制剂尼拉帕利(则乐)用于卵巢癌一线维持治疗的Ⅲ期临床PRIME达到主要研究终点。新诊断的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌中国患者接受含铂化疗产生应答后,尼拉帕利作为维持治疗可显著改善患者的无进展生存期(PFS),而且尼拉帕利总体耐受性良好。再鼎已获得葛兰素史克的授权,负责该药在中国大陆、香港和澳门地区的开发和商业化。
3.亿腾医药TPO激动剂国内报NDA。亿腾医药引进新药芦曲泊帕片的上市申请获CDE受理。芦曲泊帕是盐野义制药开发的新一代小分子TPO受体激动剂,通过作用于人TPO受体的跨膜结构域,与内源性TPO相同的方式激活信号转导途径,促进血小板的生成。该新药此前已在日本、美国、欧洲等地获批上市,用于治疗慢性肝病相关的血小板减少症患者,在进行择期侵袭性手术或诊断性操作前的升血小板治疗。
4.济民可信出售KRAS抑制剂海外权益。济民可信旗下上海济煜医药与沪亚生物国际就前者的KRAS抑制剂JMKX1899达成许可协议,沪亚生物国际将获得JMKX1899在大中华区以外的开发、生产及商业化权利。临床前研究数据显示,JMKX1899具有较强的脑通透性,且没有心脏毒性和药物-药物相互作用的风险。两家公司计划近期向FDA递交JMKX1899的临床试验申请。该新药目前已在国内申报临床。
5.FDA拒绝批准普那布林上市。万春药业发布公告,宣布该公司原创新药GEF-H1激活剂普那布林治疗化疗引起中性粒细胞减少症(CIN)的上市申请收到FDA的完全回复函(CRL)。FDA认为一项注册Ⅲ期临床不能充分证明治疗获益,要求额外开展第二项注册临床,以支持CIN适应症的获批。恒瑞医药此前已获得在大中华地区的联合开发及独家商业化普那布林的权益。
国际药讯
1.第三代乙肝疫苗获FDA批准上市。FDA批准VBI Vaccines公司第三代乙肝病毒(HBV)疫苗PreHevbrio(Sci-B-Vac)上市,用于在18岁及以上成年人中预防所有已知HBV亚型引起的感染。这也是FDA批准的首款靶向三种乙肝病毒抗原的成人HBV疫苗。在一项Ⅲ期临床中,相比单抗原HBV疫苗,PreHevbrio在总体受试者中均引起较高的血清保护率(91.4%VS76.5%),包括45岁以上的成人(89.4%VS73.1%);而且无非预期反应原性。
2.Keytruda+Lenvima组合治疗肾癌获批。欧盟委员会(EC)批准默沙东PD-1疗法Keytruda联合卫材多受体酪氨酸激酶抑制剂Lenvima,用于一线治疗晚期肾细胞癌(RCC)成人患者。在一项关键Ⅲ期临床CLEAR(Study 307/KEYNOTE-581)中,与sunitinib相比,联合治疗在多个疗效终点(OS、PFS和ORR)上均具有统计学意义的显著改善,将患者死亡风险降低了34%(HR=0.66[95%CI:0.49-0.88];p=0.0049),将患者疾病进展或死亡风险降低了61%(HR=0.39[95%CI:0.32-0.49];p<0.0001)。
3.季节性流感广谱抗体Ⅱ期临床积极。SAB Biotherapeutics公司多克隆抗体疗法SAB-176在用于治疗季节性流感的Ⅱa期临床达到主要终点。对鼻咽拭子样本中的病毒载量的分析发现,与安慰剂相比,SAB-176治疗组患者的H1N1病毒载量显著降低(单边p=0.026),流感的临床症状也显著降低(单边p=0.013)。没有观察到严重不良事件,大多数不良事件为轻中度。
4.创新APOL1靶向疗法概念验证临床积极。Vertex Pharmaceuticals公司口服小分子APOL1抑制剂VX-147治疗APOL1介导的局灶节段性肾小球硬化(FSGS)患者的Ⅱ期临床获积极结果。在13例可评估患者中,VX-147联合标准治疗使患者的第13周尿蛋白/肌酐比值较基线平均降低47.6%(95% CI:-60.0%,-31.3%);患者的蛋白尿减少在整个治疗期间得到维持。试验未发生与研究药物相关的严重不良事件。这是首款APOL1抑制剂获得临床概念验证。
5.RNA激活疗法创新组合启动临床。MiNA公司小激活RNA疗法MTL-CEBPA联合标准治疗方案(atezolizumab和贝伐珠单抗),在一线治疗晚期肝细胞癌(HCC)的Ⅰ期临床首例患者给药。MTL-CEBPA是首款特异性上调CCAAT/增强子结合蛋白α(C/EBP-α)的疗法,CCAAT/增强子结合蛋白α是一种转录因子,是髓系细胞谱系决定和分化的主要调节因子。该项试验将入组约30例不可切除或晚期HCC初治患者。试验预计将在2023年获得数据。
6.赛诺菲拟收购痤疮疫苗公司。赛诺菲宣布与奥地利Origimm biotechnology GmbH达成收购协议。Origimm是一家生物技术研发公司,致力于开发重组蛋白治疗性疫苗,以用于治疗包括痤疮等皮肤疾病。该公司主要候选品种ORI-001是一款治疗性寻常痤疮候选疫苗,该疫苗已于2021年第三季度进入初步临床研究。此次交易尚未披露价格及具体细节条款,预计将于2021年12月初完成。
医药热点
1.中国艾滋病感染人数超105万。根据日前发布在中国疾控中心周报上的《我国HIV/AIDS流行病学研究进展》,截至2020年底,中国共有105.3万人感染艾滋病病毒,累计报告死亡35.1万人。其中异性恋和同性恋传播的比例分别从2009年的48.3%和9.1%,上升到2020年的74.2%和23.3%;而注射吸毒者传播的比例从2009年的25.2%大幅下降到2020年的2.5%以下。需要注意的是,男同性行为者是感染艾滋病病毒的最高风险群体。
2.英国缩短新冠疫苗加强针间隔。英国11月29日报告新增8例感染奥密克戎毒株的确诊病例。卫生大臣赛义德·贾维德当天宣布,接种完第二剂新冠疫苗满3个月的成年人均可接种加强针。英国先前规定,接种第二剂新冠疫苗后满6个月才能接种,40岁及以上人群、存在健康问题的16岁以上人群和医务人员完成接种后,才会向其他成年人开放接种。
3.医疗机构检查检验结果互认管理办法出台。国家卫健委日前发布《医疗机构检查检验结果互认管理办法(征求意见稿)》。《征求意见稿》提出,医务人员对符合条件的检查检验结果能认尽认,医疗机构检查检验结果互认标志统一为HR;医疗机构及其医务人员应在不影响疾病诊疗的前提下,对标有全国或本机构所在地区互认标识的检查检验结果予以互认。
4.医师住培新版文件出炉。中国医师协会日前发布《住院医师规范化培训基地标准(2021年版)》和《住院医师规范化培训内容与标准(2021年版)》两个征求意见稿,以及6部《住院医师规范化培训教学活动指南》。其中,《教学指南》涵盖入院教育、教学查房、教学病例讨论、临床小讲课、临床操作技能床旁教学、住院病历书写指导六大方面,以内容的规范性、实操性为主要特色,并在整体结构、体例、格式、名词规范等方面做了统一要求。
5.北京:献血年龄可延长至60周岁。近日,北京市十五届人大常委会第三十五次会议表决通过《北京市献血条例》。《条例》提出,既往无献血反应、多次献血的健康个人主动要求再次献血的,献血年龄可以延长至60周岁。该《条例》自2022年2月1日起施行。
评审动态
1. CDE新药受理情况(12月02日)
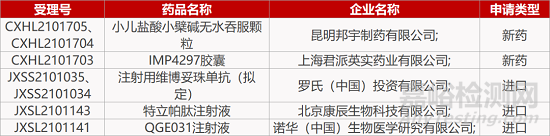

来源:药研发


