您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-23 11:33
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
三生FIC抗瘙痒药报NDA。三生制药与东丽株式会社联合开发的盐酸纳呋拉啡口腔崩解片(TRK-820,REMITCH)的新药上市申请获CDE受理,用于改善血液透析患者现有治疗疗效不理想的瘙痒症。TRK-820是由东丽株式会社自主研发的选择性阿片κ受体激动剂,通过与现有的抗组胺药或抗过敏药完全不同的新的作用机制发挥止痒作用。临床试验证实,该药物对于现有治疗抵抗的血液透析瘙痒症有明显的疗效。
国内药讯
1.辉瑞CD22-ADC治疗白血病在华获批。国家药监局通过优先审评程序批准辉瑞CD22靶向抗体偶联药物注射用奥加伊妥珠单抗(曾用名:注射用伊珠单抗奥唑米星,Besponsa)上市,用于治疗复发或难治性前体B细胞急性淋巴细胞性白血病。Besponsa是首款获FDA批准的靶向CD22的抗体偶联药物,2017年8月在美国获批上市,用于治疗成人复发或难治性B细胞前体急性淋巴性白血病。
2.罗氏CD79b-ADC拟纳入优先审评。罗氏注射用维博妥珠单抗(Polatuzumab vedotin)上市申请获CDE拟纳入优先审评,用于治疗复发或难治性弥漫大B细胞淋巴瘤。这是首个在国内申报上市的CD79b-ADC药物,也是FDA批准的首个化疗免疫疗法。最新公布于《新英格兰医学杂志》上的一项Ⅲ期临床结果显示,中位随访28.2个月时,该药联合标准治疗显著改善患者PFS(HR=0.73;95% CI:0.57-0.95:p<0.02)。
3.上海医药抗肿瘤新药获FDA临床批件。上海医药自主研发并拥有完全知识产权的抗肿瘤小分子化药SPH4336片获FDA临床许可,即将在美国开展一项用于局部晚期或转移性脂肪肉瘤的II期临床试验。在临床前研究中,SPH4336显示出良好的体内外抗肿瘤活性和安全性。在中国I期临床晚期实体瘤患者中,SPH4336获得了积极的初步疗效数据,将为美国开展II期临床研究提供依据。
4.凯惠睿智入局开发新冠鸡尾酒抗体。睿智医药旗下凯惠睿智生物与ImmunoPrecise公司达成全球抗体生产合作项目,凯惠睿智将利用其先进的抗体生产技术和全球规模化的生产设施,为后者开发和生产拟用于防治COVID-19感染的四种单抗混合物PolyTope TATX-03 Therapy中的单个鸡尾酒抗体。凯惠睿智将提供从DNA到临床制造的全面集成的一站式开发和制造。
5.箕星药业引进创新心衰药。箕星药业宣布扩大与Cytokinetics合作范围,将获得后者选择性小分子心肌肌球蛋白激活剂Omecamtiv Mecarbil用于心力衰竭患者在中国开发和商业化的授权。Omecamtiv mecarbil目前已在Ⅲ期临床中获得积极结果,研究成果已发表在新英格兰医学杂志上。根据协议,箕星药业将支付5000万美元预付款,2000万美元股权投资,以及3.3亿美元里程碑金额和一定比例的销售分成。
国际药讯
1.安进银屑病新药获批扩大适用范围。FDA批准安进口服PDE4抑制剂Otezla(apremilast)新适应症,用于治疗适合接受光疗或全身治疗的斑块状银屑病成人患者。该药此前已获批用于治疗活动性银屑病关节炎、中重度斑块型银屑病和贝赫切特综合征(Behcet)相关的口腔溃疡,自此,Otezla成为首款获批用于所有严重程度(包括轻度、中度和重度)斑块状银屑病成人患者的新型口服的全身性治疗选择。
2.新型PET示踪剂获批用于前列腺癌诊断。FDA批准Telix公司新型PET示踪剂Illuccix (TLX591-CDx)上市,用于前列腺癌诊断成像。TLX591-CDx是一款基于放射性核素-抗体偶联技术(RDC)的靶向前列腺特异性膜抗原(PSMA)的诊断型正电子发射断层扫描(PET)示踪剂,相比其他已获批的示踪剂在低PSA水平的患者中对复发的检测效果更优,已被纳入美国国立综合癌症网络前列腺癌指南(2020年版)目录。远大医药拥有TLX591-CDx的中国权益。
3.礼来IL-13抑制剂治疗湿疹Ⅲ期临床积极。礼来IL-13抑制剂lebrikizumab联合外用皮质类固醇(TCS)治疗中重度特应性皮炎的第三项关键Ⅲ期临床达到所有主要和关键次要终点。与安慰剂联合TCS相比,联合治疗第16周时研究者总体评估达到疾病严重程度较基线改善75%(EASI 75)的患者比例更高,而且组合疗法的安全性特征与已知研究一致。具体结果将于明年科学大会上公布。该公司计划明年递交监管申请。
4.A3AR激动剂治疗肝癌长期疗效积极。Can-Fite公司口服A3AR激动剂Namodenoson治疗肝细胞癌 (HCC)的II期临床扩展试验获5年治疗数据。接受治疗的最后1例患者获得完全缓解 (CR) ,所有癌症病灶全部清除,包括腹水消失、肝功能正常以及腹腔内散布性癌症消失。Can-Fite计划明年第一季度启动Namodenoson治疗潜在Child Pugh B7 (CPB7)肝硬化的晚期HCC患者的关键III期临床。康哲药业拥有该药在大中华区的授权。
5.NO疗法治疗肺动脉高压Ⅱ期临床积极。Bellerophon公司评估吸入性一氧化氮疗法INOpulse通过右心导管插入术,治疗结节病相关肺动脉高压(PH-Sarc)的Ⅱ期临床结果积极。INOpulse显著降低所有8例受试者的平均肺动脉压(mPAP)和肺血管阻力(PVR)。其中iNO45(45μg/kg IBW/hr)使患者中位PVR较基线下降20%;最高剂量iNO125(125μg/kg IBW/hr)显示PVR中位降幅为29%,与基线(p=0.02)和iNO75(75μg/kg IBW/hr)水平相比,具有统计学显著性。INOpulse的安全性特征良好。
6.罗氏布局眼部疾病细胞疗法。Lineage Cell公司和子公司Cell Cure Neurosciences 与罗氏旗下基因泰克签订全球合作许可协议,共同开发和商业化前者临床期的异体视网膜色素上皮(RPE)细胞移植疗法OpRegen®,用于治疗晚期干性年龄相关性黄斑变性(AMD)伴随地图样萎缩(GA)等眼疾。根据协议,Lineage将获得5000万美元的预付款,可能高达6.2亿美元的里程碑潜在付款,以及产品的销售分成。
7.赛诺菲收购肿瘤免疫疗法开发公司。赛诺菲宣布将以大约10亿美元的预付款收购Amunix公司。Amunix专注于开发创新T细胞结合器和细胞因子免疫疗法,以用于实体瘤的治疗。Amunix目前正在向临床推进AMX-818,其他几个T细胞结合器(包括PSMA-XPAT和EGFR-XPAT),以及蛋白酶激活的细胞因子项目IL12-XPAC。先导候选药物AMX-818是一种HER2靶向的(XPAT)T细胞接合器,预计明年初进入临床。
医药热点
1.欧洲奥密克戎主要感染人群为年轻人。当地时间12月21日,世卫组织欧洲区域办公室主任克鲁格表示,自11月下旬首次发现奥密克戎变异毒株以来,在世卫组织欧洲地区的53个国家中,至少有38个国家出现了奥密克戎感染病例。目前,它已成为丹麦、葡萄牙和英国等几个国家的主流毒株。欧洲89%的早期奥密克戎病例出现的常见冠病症状包括咳嗽、喉咙痛和发烧。大部分患者是20到30多岁的年轻人。
2.天津处方流转最新规定出台。天津市医保局发布《关于支持处方流转医保政策的通知》,自2022年1月1日起执行。通知指出,参保人员使用《基本医疗保险药品目录》药品发生的费用,由医保统筹基金支付的,应当凭医生处方或住院医嘱。处方流动所发生的药品费用,由医保经办机构与提供调剂服务的定点零售药店据实结算,纳入接诊医疗机构的医保付费总额管理指标核算范围,并优先使用接诊医疗机构的医保付费总额管理指标。
3.重庆八省吻合器带量采购中选结果公布。12月20日,重庆市医保局发布《关于公布渝琼滇桂青豫新新疆兵团腔镜吻合器和渝琼滇黔宁桂新新疆兵团静脉留置针联盟带量采购中选结果的通知》。据悉,腔镜吻合器及组件平均降幅为79.2%,最高降幅达97.9%。静脉留置针平均降幅为72.5%,最高降幅达94.1%。最终拟中选企业63家(包含关联企业),中选产品规格型号齐全。
评审动态
2. FDA新药获批情况(北美12月20日)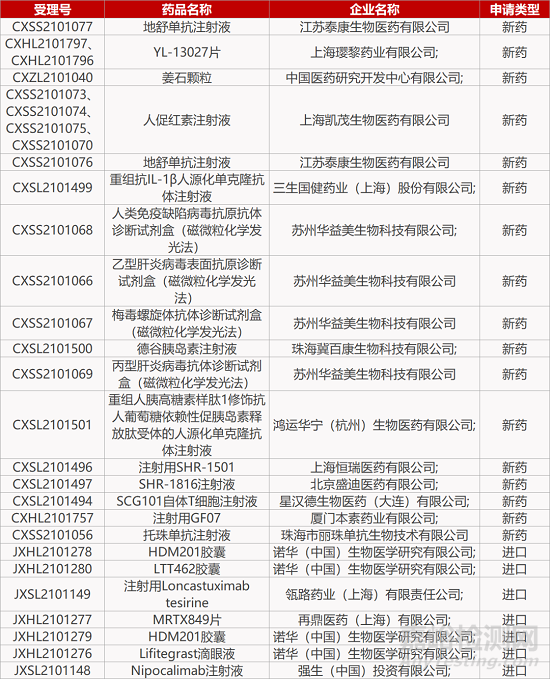
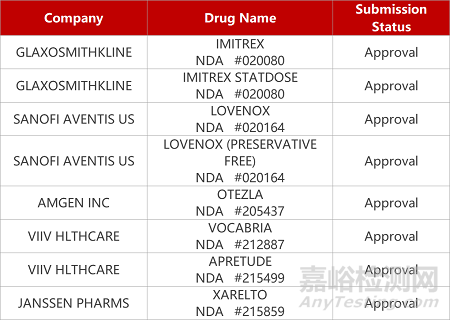

来源:药研发