您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-01-27 23:15
2021年,国家药监局以习近平新时代中国特色社会主义思想为指导,深入学习贯彻党的十九大及十九届历次全会精神,全面落实中央经济工作会议精神,按照习近平总书记“四个最严”要求,在确保产品安全有效基础上,统筹推进疫情常态化防控和医疗器械注册管理工作,加快构建与高质量发展相适应的医疗器械注册管理体系,助推产业创新发展。
一、医疗器械注册工作情况
(一)全力保障疫情防控大局
继续做好新冠疫情防控应急审批工作,2021年国家局共批准14个新冠病毒检测试剂,截至2021年年底,共批准新冠病毒检测试剂68个(包括34个核酸检测试剂、31个抗体检测试剂、3个抗原检测试剂),产能达到5130.6万人份/天,为常态化疫情防控工作提供了有力保障。启动新冠病毒突变株监测和试剂检出能力评估工作,确保已批准试剂对新冠病毒突变株的检测质量。
此外,国家药监局还批准了基因测序仪、核酸检测仪、呼吸机和血液净化装置等16个仪器设备。截止2021年底,共批准108个新冠疫情防控医疗器械产品。
《新型冠状病毒核酸检测试剂盒质量评价要求》等5项国家标准获批发布,完成了国际标准《医用电气设备第2-90部分 高流量呼吸治疗设备基本安全和基本性能》立项和起草工作,该标准于2021年8月30日正式在国际电工技术委员会(IEC)和国际标准化组织(ISO)网站上发布,这是由我国提出并负责完成的首个新冠肺炎疫情防控医疗器械国际标准。
(二)构建医疗器械注册管理法规体系新框架
发布《医疗器械注册与备案管理办法》(市场总局令第47号)《体外诊断试剂注册与备案管理办法》(市场总局令第48号)2部规章。发布《关于实施〈医疗器械注册与备案管理办法〉〈体外诊断试剂注册与备案管理办法〉有关事项的通告》(2021年第76号),明确过渡期医疗器械注册工作要求。
发布《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2021年第121号)、《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(2021年第122号)等2份申报资料要求,指导注册申请人准备注册申报资料。
发布医疗器械和体外诊断试剂临床试验、临床评价等9个指导原则,包括:《关于发布免于临床试验的体外诊断试剂临床评价技术指导原则的通告》(2021年第74号)、《关于发布体外诊断试剂临床试验技术指导原则的通告》(2021年第72号)、《关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告》(2021年第73号)(包含医疗器械临床评价技术指导原则、决策是否开展医疗器械临床试验技术指导原则、医疗器械临床评价等同性论证技术指导原则、医疗器械注册申报临床评价报告技术指导原则、列入免于临床评价医疗器械目录产品对比说明技术指导原则共5个指导原则)、《关于发布医疗器械临床试验数据递交要求等2项注册审查指导原则的通告》(2021年第91号),科学设置医疗器械临床评价要求。发布《关于发布免于临床试验体外诊断试剂目录的通告》(2021年第70号)、《关于发布免于临床评价医疗器械目录的通告》(2021年第71号) 对423个体外诊断试剂、1010个医疗器械免于临床试验、临床评价。
发布《境内第三类和进口医疗器械注册审批操作规范》(国药监械注〔2021〕53号)、《境内第二类医疗器械注册审批操作规范》(国药监械注〔2021〕54号)等2份操作规范,规范各级药品监管部门注册审批工作。
发布《医疗器械注册自检管理规定》的公告(2021年第126号),明确医疗器械注册自检工作管理要求。
发布《医疗器械应急审批程序》,总结新冠疫情防控经验,完善医疗器械应急审批要求。
发布《体外诊断试剂分类规则》(2021年第129号),指导体外诊断试剂分类工作。
相关文件按照习近平总书记“四个最严”要求,充分落实两办42号文件意见,吸纳审评审批制度改革成果,全面落实注册人制度、科学设置评价要求、鼓励创新发展,从申报资料要求、程序、操作规范、临床评价、产品检验等多方面进行了详细规定,逐一落实新《条例》注册管理要求,搭建起了新的注册管理法规体系。
(三)鼓励医疗器械产业高质量发展
持续鼓励医疗器械创新发展,批准冠脉血流储备分数计算软件等35个创新医疗器械上市,至2021年底,获批上市创新医疗器械达到134个,满足人民群众使用高水平医疗器械的需要。
按照优先医疗器械审批程序,批准遗传性耳聋基因检测试剂盒等19个[J1]医疗器械上市,至2021年底,获批上市优先医疗器械达到49个[J2],更好地满足临床使用需求。
成立生物材料创新合作平台,配合工信部门启动人工智能医疗器械创新任务揭榜挂帅工作,建立主文档登记制度,加速推进新材料、新技术、新产品上市,助力产业高质量创新发展。
继续支持海南博鳌乐城国际医疗旅游先行区、粤港澳大湾区等重点区域建设,指导做好临床急需少量医疗器械进口工作,稳步推进临床真实世界数据应用试点工作,批准第2个采用临床真实世界数据的“飞秒激光眼科治疗系统”上市。
优化药械组合产品上市证明要求,发布《关于药械组合产品注册有关事宜的通告》(2021年第52号),加快有临床价值的药械组合产品上市步伐。
(四)夯实医疗器械注册管理基础
1.标准体系持续健全。联合国家标准委印发《关于进一步促进医疗器械标准化工作高质量发展的意见》。举办2021年“世界标准日”医疗器械标准化主题活动,加强医疗器械标准化理念宣传。
成立医疗器械临床评价和医用高通量测序2个标准化技术归口单位,标准组织体系进一步健全;持续实施标准提高计划,2021年批准79项行业标准制修订计划项目,审核发布146项行业标准;对396项强制性标准和62项强制性标准在研项目全面优化评估,截至2021年底,现行有效医疗器械标准共1849项,其中国家标准235项,行业标准1614项,标准体系覆盖性、系统性不断提升。
2.分类命名工作更加有效。发布《分类目录动态调整工作程序》,规范分类目录调整工作,完成分类界定1993项;发布修订后《第一类医疗器械产品目录》;制定《体外诊断试剂分类规则》,规范体外诊断试剂分类管理;制定重组胶原蛋白和人工智能类产品分类界定原则;积极推进医美产品等社会关注度高的热点产品、边缘产品和药械组合产品属性及分类研究;发布9项命名指导原则,进一步指导医疗器械规范命名。
3.唯一标识工作稳步推进。会同卫生健康委、医保局推进第一批高风险品种唯一标识实施工作;联合印发第二批实施公告,明确实施品种和政策要求;积极推进唯一标识示范单位建设;组织完善唯一标识数据库,截至目前,数据库已有105万条数据。深入推进省级唯一标识全域试点工作,扩大品种范围,探索唯一标识实施应用。
4.分中心建设取得实质进展。国家药监局医疗器械技术审评检查长三角、粤港澳大湾区2个分中心正式运行,人员队伍配备管理不断完善,有序开展审评核心业务,构建创新医疗器械主动服务工作机制,积极开展申请人的沟通指导,推动长三角、大湾区医疗器械产业创新发展。
5.规范统一技术审查标准。发布医疗器械动物试验研究注册审查指导原则、乳腺X射线机等共73项注册技术审查指导原则,统一和规范各级各地医疗器械注册技术审查尺度,提升审查能力。
(五)强化医疗器械注册管理能力建设
1.持续做好医疗器械注册法规培训。国家局成立《条例》宣讲团,采取多种形式,深入宣贯《条例》要求,确保宣贯准确性和权威性。组织2期约1000余名基层业务骨干培训班。各省(区、市)局将《条例》宣贯纳入年度重点工作,开展形式多样的宣贯培训。
依托北京、上海、江苏、浙江、山东、广东6省(市)局,建立第二类医疗器械审评实训基地,按照专业特长统筹开展培训,10期培训近7000人次参加,为提升省级审评能力奠定基础。
国家药监局器审中心不断拓展业务培训内容和形式,组织10期系统内监管人员、技术人员的业务培训,覆盖基层9000余人次;“器审云课堂”在学习强国上线,提供法规解读、审评要点讲解等内容,收录课程145期,累计播放110余万次。
2.启动法规制度研究。国家药监局成立12个省(市)局牵头,各省(区、市)局参与的监管法规制度研究组。围绕12个监管主题,注重跟踪国际法规进展,紧密结合我国监管实践,以问题为导向,开展研究,为后续完善监管制度提供支撑。
3.持续推进监管科学研究。强化监管科学研究基地建设和管理,完成第一批4个监管科学研究重点项目,制定新工具、新方法、新标准及相关报告37项。组织遴选确定第二批6个医疗器械监管科学重点项目。
4.深入开展国际交流合作。深入参与国际医疗器械监管者论坛(IMDRF)6个项目组研究,我国牵头的“上市后临床随访研究”成果文件获批发布。积极参与全球医疗器械法规协调会(GHWP)工作,牵头制定GHWP UDI指南,开展UDI能力建设培训。举办第十二届中国医疗器械监督管理国际会议(CIMDR)。
(六)加强医疗器械注册监督管理
1.开展第一类医疗器械备案清理规范工作。以医用冷敷贴类产品为重点,全面清理规范境内第一类医疗器械备案。清理规范过程中,各设区的市级备案部门开展自查、省局开展检查、国家局派出6个检查组赴11个省开展抽查。后续通过宣传培训、督促通报、年终考核等方式,持续加大工作力度,确保清理规范取得良好效果,有效净化了市场环境。
2.强化临床试验管理。强化临床试验机构和临床试验项目监督管理,加强临床试验法规宣传培训力度。严肃查处临床试验过程中的违法违规行为。对广州海力特生物科技有限公司体外诊断试剂产品临床试验有因检查中发现的临床试验数据无法溯源等问题依法处理。
3.部署开展二类医疗器械清理规范工作。在全国范围内部署第二类医疗器械注册清理规范工作,印发工作方案,进一步规范全国第二类医疗器械注册管理工作。
二、医疗器械注册申请受理情况
2021年,国家药监局依职责共受理医疗器械首次注册、延续注册和变更注册申请12255项,与2020年相比增加15.8%。
(一)整体情况
受理境内第三类医疗器械注册申请5338项,受理进口医疗器械注册申请6917项。
按注册品种区分,医疗器械注册申请8540项,体外诊断试剂注册申请3715项。
按注册形式区分,首次注册申请2750项,占全部医疗器械注册申请的22.4%;延续注册申请5875项,占全部医疗器械注册申请的48%;变更注册申请3630项,占全部医疗器械注册申请的29.6%。注册形式比例情况见图1。
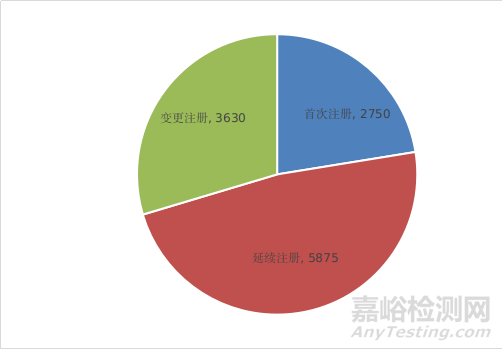
图1 注册受理项目注册形式比例图
(二)分项情况
1.境内第三类医疗器械注册受理情况
境内第三类医疗器械注册受理共5338项,与2020年相比增加26.5%。其中,医疗器械注册申请3733项,体外诊断试剂注册申请1605项。
从注册形式看,首次注册1880项,占全部境内第三类医疗器械注册申请数量的35.2%;延续注册2156项,占全部境内第三类医疗器械注册申请数量的40.4%;变更注册1302项,占全部境内第三类医疗器械注册申请数量的24.4%。注册形式分布情况见图2。
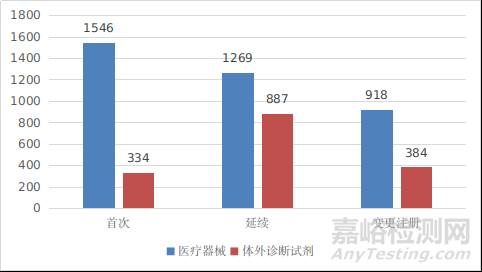
图2 境内第三类医疗器械注册受理项目注册形式分布图
2.进口第二类医疗器械注册受理情况
进口第二类医疗器械注册受理共3689项,与2020年相比增加11.4%。其中医疗器械注册申请2048项,体外诊断试剂注册申请1641项。
从注册形式看,首次注册435项,占全部进口第二类医疗器械注册申请数量的11.8%;延续注册2122项,占全部进口第二类医疗器械注册申请数量的57.5%;变更注册1132项,占全部进口第二类医疗器械注册申请数量的30.7%。注册形式分布情况见图3。

图3 进口第二类医疗器械注册受理项目注册形式分布图
3.进口第三类医疗器械注册受理情况
进口第三类医疗器械注册受理共3228项,与2020年相比增加5.9%。其中医疗器械注册申请2759项,体外诊断试剂注册申请469项。
从注册形式看,首次注册435项,占全部进口第三类医疗器械注册申请数量的13.5%;延续注册1597项,占全部进口第三类医疗器械注册申请数量的49.5%;变更注册1196项,占全部进口第三类医疗器械注册申请数量的37%。注册形式分布情况见图4。
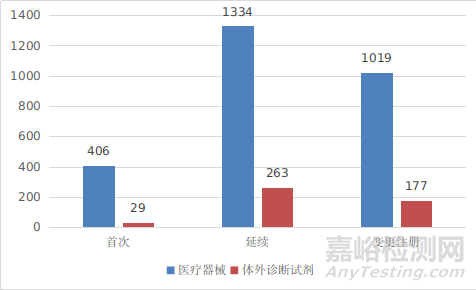
图4 进口第三类医疗器械注册受理项目注册形式分布图
三、医疗器械注册审批情况
2021年,国家药监局共批准医疗器械首次注册、延续注册和变更注册11314项,与2020年相比注册批准总数量增长14.9%。
其中,首次注册1710项,与2020年相比增加8.8%。延续注册6939项,与2020年相比增加25.6%。变更注册2665项,与2020年相比减少3.1%。
2021年,企业自行撤回注册申请182项,自行注销注册证书49项。
近8年国家药监局批准医疗器械注册情况见图5。

图5 2014至2021年度注册数据图
(一)整体情况
2021年,国家药监局批准境内第三类医疗器械注册4596项,与2020年相比增加27.6%,进口医疗器械6718项,与2020年相比增加7.6%。
按照注册品种区分,医疗器械7844项,占全部医疗器械注册数量的69.3%;体外诊断试剂3470项,占全部医疗器械注册数量的30.7%。
按照注册形式区分,首次注册1710项,占全部医疗器械注册数量的15.1%;延续注册6939项,占全部医疗器械注册数量的61.3%;变更注册2665项,占全部医疗器械注册数量的23.6%。注册形式比例情况见图6。

图6 2021年注册形式比例图
(二)分项情况
1.境内第三类医疗器械注册审批情况
境内第三类医疗器械注册4596项。其中,医疗器械3079项,体外诊断试剂1517项。

图7 境内第三类医疗器械注册形式分布图
从注册形式看,首次注册1131项,占全部境内第三类医疗器械注册数量的24.6%,延续注册2619项,占全部境内第三类医疗器械注册数量的57%;许可事项变更注册846项,占全部境内第三类医疗器械注册数量的18.4%。注册形式分布情况见图7。
2.进口第二类医疗器械注册审批情况
进口第二类医疗器械注3649项。其中,医疗器械注册2132项,体外诊断试剂注册1517项。

图8 进口第二类医疗器械注册形式分布图
从注册形式看,首次注册281项,占全部进口第二类医疗器械注册数量的7.7%;延续注册2420项,占全部进口第二类医疗器械注册数量的66.3%;许可事项变更注册948项,占全部进口第二类医疗器械注册数量的26%。注册形式分布情况见图8。
3.进口第三类医疗器械注册审批情况
进口第三类医疗器械注册3069项。其中,医疗器械注册2633项,体外诊断试剂注册436项。
从注册形式看,首次注册298项,占全部进口第三类医疗器械注册数量的8.3%;延续注册1900项,占全部进口第三类医疗器械注册数量的61.9%;许变更注册871项,占全部进口第三类医疗器械注册数量的28.4%。注册形式分布情况见图9。

图9 进口第三类医疗器械注册形式分布图
(三)首次注册项目月度审批情况
2021年,国家药监局共批准医疗器械首次注册1710项,月度审批情况见图10。

图10 首次注册项目月度审批图
(四)具体批准品种种类分析
注册的境内第三类医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中18个子目录的产品。
注册数量前五位的境内第三类医疗器械是:无源植入器械、注输、护理和防护器械、神经和心血管手术器械、医用成像器械和有源手术器械,与2020年相同,但相同类别注册数量均有大幅增加,其中有源手术器械增加48.8%,医用成像器械增加13.8%,神经和心血管手术器械增加54.2%,注输、护理和防护器械增加32.2%,无源植入器械增加3.9%。

图11 境内第三类医疗器械注册品种排位图
注册的进口医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中20个子目录的产品。
注册数量前五位的进口医疗器械,主要是:医用成像器械、无源植入器械、口腔科器械、神经和心血管手术器械、眼科器械,与2020年相同。其中,医用成像器械从2020年的63项,增加到70项,增加约11.1%。无源植入器械从41项增加到48项,增加约17.1%,其余类别注册数量略有减少。
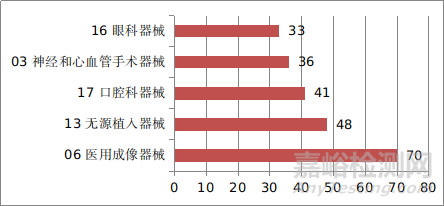
图12 进口医疗器械注册品种排位图
(五)进口医疗器械国别情况
2021年,共有27个国家(地区)产品在我国获批上市,其中,美国、德国、日本、韩国、瑞士医疗器械在中国医疗器械进口产品首次注册数量排前5位,注册产品数量约占2021年进口产品首次注册总数量的72.5%,与2020年基本持平。

图13 进口医疗器械注册国别排位图
从进口医疗器械代理人分布看,共有13个省涉及有本省企业作为进口医疗器械代理人,其中上海市代理人代理的进口首次医疗器械数量最多,占全部进口医疗器械数量的60.1%。

图14 代理人代理的进口医疗器械数量省份排位图
(六)境内第三类医疗器械省份分析
从2021年境内第三类医疗器械注册情况看,相关注册人主要集中在沿海经济较发达省份。其中,江苏、广东、北京、上海、山东是境内第三类医疗器械首次注册数量排前五名的省份,占2021年境内第三类医疗器械首次注册数量的67.9%,与2020年相比增加4.9%。

图15 境内第三类医疗器械注册省份排位图
四、创新医疗器械等产品注册审批情况
2021年,国家药监局按照《创新医疗器械特别审查程序》《医疗器械优先审批程序》继续做好相关产品的审查工作,共收到创新医疗器械特别审批申请249项,比2020年增加26.4%,其中62项获准进入特别审查程序,收到优先申请41项,比2020年增加46.3%,其中14项获准优先审批。
从2014年至2021年,国家药监局共批准134个创新医疗器械,其中,境内创新医疗器械涉及14个省的104家企业,进口创新医疗器械涉及2个国家的5个企业。
北京、上海、广东、江苏、浙江创新医疗器械获批产品数量和相应企业数量最多,约占全部已批准的134个创新医疗器械的81%。

图16 境内创新医疗器械注册省份排位图(蓝色:产品数量,红色:企业数量)
2021年,国家药监局共批准35个创新医疗器械产品上市,相比2020年,增加35%。这些创新产品核心技术都有我国的发明专利权或者发明专利申请已经国务院专利行政部门公开,产品主要工作原理/作用机理为国内首创,具有显著的临床应用价值。以下是已批准创新医疗器械产品介绍:
(一)髂动脉分叉支架系统:该产品用于治疗腹髂动脉瘤或髂总动脉瘤,是我国自主研发的第一款重建髂内动脉医疗器械,具有完全自主知识产权。该产品可直接与腹主动脉分叉支架的分支连接,术中使用较少的支架,连接点更少,相对稳定,避免连接位置内漏等并发症的发生,同时还可以减少支架使用数量,降低患者治疗费用。对于操作手术的医生而言,该产品输送器操作简单,释放定位精准,可以有效降低术中操作风险,能够为国内腹髂动脉瘤及髂总动脉瘤患者带来新的治疗选择。
(二)锚定球囊扩张导管:该产品是国内首个导引导管内采用球囊锚定方式进行导管交换的创新医疗器械,用于冠状动脉粥样硬化等疾病导致的冠状动脉狭窄介入手术治疗,可降低在推送过程中损伤导引导管的风险,预期可减少血管并发症,缩短手术时间,提高手术成功率。
(三)一次性使用血管内成像导管:该产品需配合光学干涉断层成像系统使用,用于在医疗机构中对需要进行腔内介入治疗患者的冠状动脉成像。成像导管适用于直径2.0到3.5mm的血管,不适用于左冠状动脉主干或以前做过旁路手术的目标血管。该产品经过全光纤结构成像透镜设计、光传输链路优化设计和验证测试,在冠状动脉介入治疗手术中完全去除“冲洗导管”这一步骤,以一种特定伪像的微弱增加为代价,避免了更多造影剂和导管腔杂质微粒被冲进患者血管内的风险,简化了医生PCI手术步骤,缩短病人手术时间,减少术中造影剂用量,减少病人痛苦,图像质量可达到同类产品的水平。该产品的免冲洗设计在保证成像质量的前提下,更方便医生使用并节省宝贵时间;在成像导管的开发上,降低了制作成本,减轻病人的经济负担,能够推动血管OCT技术的临床应用。
(四)一次性使用电子输尿管肾盂内窥镜:该产品由头端部、弯曲部、插入部、操作部、工作通道和连接部组成,在医疗机构中使用,与图像处理装置配合,用于人体尿道、膀胱、输尿管肾盂的观察成像。该产品的头端部塑料光纤传导光源,镜头模组捕捉光信号,CMOS模组将光信号转化成电信号,传输至图像处理装置;工作通道为送水、其他器械进入提供通道。通过采用新材料和新技术实现降低成本,同时达到和传统内窥镜相似的产品性能。该产品采用一次性使用方式,一方面降低了因重复使用导致的交叉感染等风险,另一方面减少了清洗消毒灭菌等重复使用过程,同时避免了因产品老化性能下降而带来的观察效果不佳。
(五)幽门螺杆菌23S rRNA基因突变检测试剂盒(PCR-荧光探针法):该产品包括核酸提取试剂和扩增反应试剂,由两个包装盒组成,基于磁珠法核酸提取和荧光定量PCR技术,用于体外定性检测幽门螺杆菌感染患者胃黏膜组织样本中幽门螺杆菌23S rRNA基因两个多态性位点的三种点突变A2142G、A2143G和A2142C。该产品是国内上市的首个幽门螺杆菌23S rRNA基因突变检测试剂盒,用于幽门螺杆菌克拉霉素耐药的临床辅助诊断,为临床医生评估个体中幽门螺杆菌的耐药特性提供参考。
(六)冠状动脉CT血流储备分数计算软件:该产品由软件安装光盘组成,功能模块包括:冠脉提取模块、图像切割模块、FFR展示模块、血流动力学计算FFR模块。该产品基于冠脉CT血管影像计算获得CT血流储备分数,在进行冠脉血管造影检查之前,辅助培训合格的医技人员评估稳定性冠心病患者的功能性心肌缺血症状。该产品对冠状动脉CT造影(CCTA)影像进行三维重建冠状动脉血管树,冠脉分割后,基于有限元分析和流体力学模拟仿真计算,求解出目标血管每一个位置的CT血流储备分数。在CCTA检查基础上,该产品可无创评价病变血管功能,既能够从解剖结构方面评估病变血管的狭窄程度,又能够从血流动力学方面反映临床当前情况下心肌灌注/缺血程度,改善了CCTA检查的特异性不高的情况。
(七)经导管主动脉瓣系统:该产品由主动脉瓣、配套的输送器及安装使用的压握装载系统组成。主动脉瓣由自扩张镍钛合金支架、裙布、瓣叶及缝合线组成。用于经心脏团队评估认为需要接受主动脉瓣置换但不适合接受常规外科手术置换瓣膜的重度主动脉瓣钙化性狭窄患者。该产品通过外裙边设计,减少瓣周漏的风险;其瓣膜结构可以使瓣架更有效地撑开狭窄的病变瓣环,同时与瓣叶结合避免遮挡冠脉血管开口;输送器具有可回收和重新定位的功能,有助于解决“定位难”的问题,为患者带来更好的治疗效果。
(八)临时起搏器:该产品由非植入式脉冲发生器及患者电缆组成。适用于心房或心室的体外临时起搏;也适用于在起搏器和除颤器植入过程中用于对起搏电极系统进行分析。该产品是国产首例临时心脏起搏器,既可用于对心动过缓患者进行临时起搏,还可作为一台起搏系统分析仪使用,对起搏系统进行的分析,包括阻抗测量、起搏阈值和感知幅值测量等。该产品上市可提高医院对设备的使用效率,降低医院的设备使用成本,促进起搏疗法在我国的应用。
(九)紫杉醇洗脱PTCA球囊扩张导管:该产品通过工艺改进和创新,改善了药物与球囊表面的亲和性,有利于形成分布均匀的药物涂层,提高涂层的整体结合强度。适用于对患有冠状动脉支架内再狭窄的患者进行经皮腔内血管成形术。目前越来越多的冠心病患者接受介入治疗,并置入冠脉支架。但一段时间后,部分患者可能出现支架内再狭窄。本产品通过球囊充压扩张,机械性扩张再狭窄部位,同时药物涂层中紫杉醇快速释放,起到抑制血管内膜增生的作用,预期提高靶血管远期通畅率,提高患者生活质量,为支架内再狭窄的患者提供了新的治疗选择。
(十)周围神经套接管:该产品由壳聚糖材料经乙酰化制成,呈无色或淡黄色半透明管状。用于非病理性神经损伤的上肢正中神经、尺神经、桡神经离断伤(神经缺损长度不大于2 cm),进行神经断端的端对端无张力套接缝合修复。神经套接管产品可通过外科手术与神经两断端进行缝合(套管内神经断端之间留出2mm的小间隙),以暂时固定支持损伤神经的两断端,并为两断端神经提供一个相对封闭的空间,有助于引导神经元的轴突轴向生长,同时利用周围神经选择性再生的特点有效促进神经的准确对接,减少外生和形成神经瘤的发生,可代替传统的神经外膜或神经束膜缝合方法。另外,产品采用的经乙酰化的壳聚糖材料可降解并被人体吸收,在国内已上市神经修复产品中尚无应用。
(十一)三维电子腹腔内窥镜:该产品由腹腔镜头端、腹腔镜管、腹腔镜盒、通信光纤组成,与型号MVS-1080内窥镜图像处理器配合使用,通过视频监视器提供影像供胸腔、腹腔观察、诊断、摄影或治疗用。该产品插入部分内置两路图像传感器采集图像信号,经过图像处理器合成后,操作者佩戴3D眼镜可观察到立体效果图像,使解剖层次更明显,增加了手术视野的立体感和纵深感,有利于完成各项手术操作。该产品核心技术已获国家发明专利授权。该产品的上市预期可降低设备价格,有利于临床应用和推广,使更多的患者受益。
(十二)经导管主动瓣系统:该产品由主动脉瓣、配套的输送器及安装使用的压握装载系统组成。主动脉瓣由自扩张镍钛合金支架、裙布、瓣叶及缝合线组成。用于经心脏团队评估认为需要接受主动脉瓣置换但不适合接受常规外科手术置换瓣膜的重度主动脉瓣钙化性狭窄患者。该产品通过外裙边设计,减少瓣周漏的风险;其瓣膜结构可以使瓣架更有效地撑开狭窄的病变瓣环,同时与瓣叶结合避免遮挡冠脉血管开口;输送器具有可回收和重新定位的功能,有助于解决“定位难”的问题,为患者带来更好的治疗效果。
(十三)自膨式动脉瘤瘤内栓塞系统:该产品由植入物和输送导丝组成,其中植入物为镍钛合金丝、铂丝/镍钛合金复合丝编织而成的自膨式网状结构。用于在大脑中动脉分叉部,颈内动脉末端,前交通动脉复合体或基底动脉顶端使用,对动脉瘤直径为3mm至10mm,且瘤颈尺寸≥4mm或者瘤颈比>1且<2的囊状宽颈颅内分叉部动脉瘤成年患者进行血管内治疗。颅内分叉部宽颈动脉瘤不及时闭塞或者闭塞效果不持久可能会发生动脉瘤破裂,造成生命危险。该产品采用微创介入方式植入动脉瘤后,植入物自动膨胀,通过机械阻塞防止血液流入动脉瘤,为治疗破裂和未破裂的宽颈分叉动脉瘤提供新的治疗手段,且术后无需使用双重抗血小板治疗,提升安全性。目前国内外市场尚无设计和预期用途相似的其他同类产品上市。
(十四)陡脉冲治疗仪:该产品由主机、脚踏开关、电极消融针及电源线组成,用于肝脏恶性实体肿瘤的消融治疗。该产品基于不可逆电穿孔原理,主机输出单相陡脉冲电信号,通过电极消融针经皮穿刺作用于靶组织,在靶区产生高压脉冲电场导致细胞膜产生不可逆的穿孔效应,使细胞快速凋亡,从而实现治疗肿瘤的效果。该产品为首个利用不可逆电穿孔原理治疗肝脏肿瘤的国产医疗器械,治疗过程几乎没有温度变化,不受热量传导等因素影响,对血管神经等组织具有一定的保护作用,针对某些特殊部位的肝脏肿瘤治疗相比常规产品具有一定的优势。该产品上市有利于临床应用推广和降低临床治疗费用,使更多肝脏肿瘤患者受益。
(十五)冠状动脉CT血流储备分数计算软件:该产品由软件安装光盘组成,功能模块包括:冠脉提取模块、图像切割模块、FFR展示模块、血流动力学计算FFR模块。该产品基于冠脉CT血管影像计算获得CT血流储备分数,在进行冠脉血管造影检查之前,辅助培训合格的医技人员评估稳定性冠心病患者的功能性心肌缺血症状。该产品对冠状动脉CT造影(CCTA)影像进行三维重建冠状动脉血管树,冠脉分割后,基于有限元分析和流体力学模拟仿真计算,求解出目标血管每一个位置的CT血流储备分数。在CCTA检查基础上,该产品可无创评价病变血管功能,既能够从解剖结构方面评估病变血管的狭窄程度,又能够从血流动力学方面反映临床当前情况下心肌灌注/缺血程度,改善了CCTA检查的特异性不高的情况。
(十六)颅内药物洗脱支架系统:该产品含有药物涂层支架及快速交换球囊导管输送系统。药物涂层支架以316L不锈钢支架为基体,表面涂覆底部涂层和含雷帕霉素高分子可降解涂层。用于颅内动脉粥样硬化性狭窄,参考血管直径为2.25~4.0mm,适用的病变长度小于等于15mm。目前治疗颅内动脉粥样硬化性狭窄的主要手段有药物治疗、血管内介入治疗。研究表明,药物治疗短期安全性较好,但长期卒中复发率仍较高,且对于颅内动脉狭窄程度较高(狭窄≥70%,≤99%)患者的治疗效果不显著。血管内介入治疗由于创伤较小,术后血管即刻开通率高,但一年内支架再狭窄率较高。该产品中雷帕霉素可抑制血管平滑肌细胞的过度增生,降低支架内再狭窄发生率,从而减少远期再发卒中的风险。目前国内外市场尚无设计和预期用途相似的其他同类产品上市。
(十七)腔静脉滤器:该产品由滤器和输送系统组成,通过经股静脉或经颈静脉入路经皮置入滤器,用于预防下腔静脉系统栓子脱落而引起的肺动脉栓塞(PE)。该产品为首个国产伞状结构的可回收腔静脉滤器,回收期达到3个月,确保血栓充分过滤,提高了滤器的回收率,为临床治疗提供更多选择。
(十八)单髁膝关节假体:该产品由股骨髁和组配式胫骨平台组成,组配式胫骨平台由胫骨平台垫和胫骨平台托组成,与骨水泥配合使用,适用于膝关节单侧髁置换。在治疗单间室骨关节炎方面,单髁膝关节置换术较全膝关节置换术的创伤相对更小、恢复较快,手术并发症较少、术后功能较好。该产品能够有效的治疗膝关节单侧间室疾病,并能够很好的恢复膝关节下肢力线,为临床提供更多治疗选择。
(十九)内窥镜用超声诊断设备:该产品由主机、探头驱动器、超声小探头、脚踏开关、台车组成,与上消化道内窥镜联合,用于对上消化道进行超声诊断检查。该产品在常规内窥镜直接观察消化道粘膜表面的病变基础上,利用超声探头可以对病变粘膜下组织进行超声扫描观察,增强常规内镜检查的诊断效果。不仅能得到人体消化道壁的表层图像,还能同时得到周围器官的断层图像,通过一次检查便可获取多元信息。该产品为首个国产内窥镜超声诊断设备,产品采用自主开发的高频超声硬件、微型成像探头以及高性能软件构架和图像处理新技术,可以极大地提升内窥镜下超声影像质量,有助于发现早期消化道肿瘤,提高患者的生存率。
(二十)机械解脱弹簧圈:该产品由弹簧圈和推送杆组成,解脱方式为机械解脱。适用于颅内的动脉瘤瘤内栓塞、动静脉畸形和动静脉瘘填塞,以及外周血管系统动脉、静脉病变的填塞。该产品利用推送杆将弹簧圈输送至动脉瘤内,解脱释放弹簧圈,再利用弹簧圈的机械闭塞作用以及继发的血栓闭塞作用,将动脉瘤隔绝于载瘤动脉的血循环之外,从而达到防止动脉瘤再破裂的目的。该产品的销索式机械解脱结构设计有助于提高解脱成功率,使操作更安全、方便,为临床提供更多治疗选择。
(二十一)经导管主动脉瓣膜及可回收输送系统:该产品由瓣膜、输送系统、装载工具和导丝组成。瓣膜由三片瓣叶(牛心包)、裙边(PET)、夹片(镍钛)与自膨胀支架(镍钛)通过缝合线(PTFE)缝合而成。输送系统主要由导管和手柄组成,包含电池。用于经心脏团队结合评分系统评估后认为:患有有症状的、钙化的、重度退行性自体主动脉瓣狭窄,不适合接受常规外科手术置换瓣膜、年龄大于等于70岁的患者。该产品的输送系统可实现瓣膜在体内未完全释放的情况下重新回收并再次定位和释放,周向螺旋循环加强筋以及镂空槽的设计使输送系统具备多向弯曲能力,提升其在血管中的通过性,从而减少血管并发症风险。
(二十二)口腔种植手术导航定位设备:该产品由马达夹持器、种植台车、视觉与显示器台车、手术导航软件组成;与配套附件联合使用,用于成人口腔种植手术过程中种植体的导航定位。该产品为具有自主知识产权的国内首创医疗器械。核心技术包括空间映射、手术路径规划和手术路径定位,具有种牙手术视觉导航的配准方法及电子设备、种植手机夹持装置、口腔种植手术定位装置及手术路径规划方法的发明专利。该产品临床优势主要为保证种植体植入精度。
(二十三)水动力治疗设备和一次性使用清创水动力刀头:水动力治疗设备由主机、脚踏开关、废液桶、电源线、接地线构成;一次性使用清创水动力刀头由输液管组件、高压管、废液管组件、泵体及手柄组件组成。两个产品配合使用,预期用于伤口清创(急性和慢性伤口、烧伤)、软组织清创。该产品为首个利用高压水动力进行清创治疗的国产产品,为国内首创。该产品采用专利技术,实现连续精细水流控制,将压力控制在较高的精度范围内。两种不同结构的刀头可分别实现高效和精细切割,以适应不同临床需求。同时配有基于RFID的电子标签识别功能,实现主机和刀头的自动识别配对。相较于常规金属锐器清创疗法,水动力清创以其术程短,低损伤伤口控制、精准切割与分离、高效清除细菌及细菌生物膜、同步裹挟带走废弃物以及减少污染等特点,满足精准外科的要求,降低了手术难度,最大限度保留伤口正常组织,促进伤口快速愈合。
(二十四)医用电子直线加速器:该产品由辐射头、机架、kV成像系统、MV成像系统、治疗床、主控柜、计算机柜、控制键盘、控制台计算机、隔离变压器、调制器和X射线高压发生器组成。用于对肿瘤患者进行三维适形放射治疗、调强放射治疗、旋转放射治疗、图像引导放射治疗。该产品采用的正交双层多叶准直技术,属国内首创。其临床优势为提高靶区剂量适形度和剂量均一性,针对包含单层多叶准直器的直线加速器,该产品可更好的保护危及器官,更好的满足临床对复杂病例精准治疗的需求。
(二十五)球囊扩张血管内覆膜支架系统:该产品由血管内覆膜支架以及输送系统两部分组成,其中血管内覆膜支架预装在PTA球囊上。血管内覆膜支架包含316L不锈钢环和覆膜。用于治疗髂总动脉和髂外动脉的原发闭塞性病变,包括主髂动脉分叉部位的原发闭塞性病变。支架的金属部分采用独立的不锈钢环结构,通过覆膜彼此相连,预期可获得较高的径向支撑力和柔顺性。球囊扩张支架的设计有助于提供较好的径向支撑力、提高直径的可调节性及放置的准确性。该产品为髂总动脉和髂外动脉的原发闭塞性病变患者提供了新的治疗选择。
(二十六)腹腔内窥镜手术设备:该产品由医生操作台、患者操作台、手术器械、电源线和线缆组成。由医师利用主从操控系统对于微创手术器械进行控制,用于胆囊切除术、腹股沟疝手术、食道裂孔疝修补及胃底折叠术、肝囊肿开窗术、阑尾切除术和袖状胃切除术。该产品为国内首个采用主从控制进行腹腔手术操作的设备,采用末端解耦的丝传动多自由度手术器械设计,增强了医生操作的灵活性;折展式远端定心器械操作臂设计使其具有小型轻量化的优点;基于异构端端映射的主从操作模式,可以实现位姿分离控制。该产品上市有利于减少手术并发症,提升患者生活质量;缓解医生疲劳;降低应用成本。
(二十七)胚胎植入前染色体非整倍体检测试剂盒(可逆末端终止测序法):该产品是基于新一代的高通量测序平台研制的体外诊断试剂,可对胚胎囊胚期活检细胞中染色体数目异常进行定性检测,用于定性检测试管婴儿过程中体外培养胚胎的囊胚滋养层细胞的脱氧核糖核酸(DNA),通过对胚胎部分细胞的 DNA 进行检测,分析胚胎染色体是否存在非整倍体数量异常,辅助临床医生判断胚胎是否植入。 该产品与已批准上市的同类产品测序原理不同,胚胎染色体非整倍体算法不同。通过胚胎植入前染色体非整倍体检测,有助于减少植入染色体数目异常的胚胎,减少因植入异常胚胎而造成的反复种植失败、反复流产、出生缺陷等。
(二十八)持续葡萄糖监测系统:产品用于糖尿病成年患者(≥18岁)的组织间液葡萄糖水平的连续或定期监测,可提供并存储连续葡萄糖值,供用户跟踪葡萄糖浓度变化的趋势。属国内首创,临床优势为14天的使用期限内无需指尖血校准。
(二十九)生物疝修补补片:该产品是由猪膀胱基底膜和猪小肠粘膜下层经过脱细胞处理、复合制成的三明治结构补片,有贯穿孔。产品经环氧乙烷灭菌,一次性使用。用于开放和腹腔镜术式腹膜外修补腹股沟疝和股疝。该产品为天然组织来源的生物再生材料,植入体内后可完全降解。其结构设计为“粘膜下层+基底膜”的仿生结构,组织相容性较好;贯穿整个材料的孔洞,加速周围组织细胞长入,利于组织液流动。此外,产品的复合结构可以提升水化后补片的操作手感,有利于缩短手术操作时间。
(三十)植入式左心室辅助系统:该产品由血泵、体外控制器、可充电锂电池、适配器、电池充电器、通讯隔离模块、监控器、手术工具、淋浴包组成。与特定人工血管配套使用,为进展期难治性左心衰患者血液循环提供机械支持,用于心脏移植前或恢复心脏功能的过渡治疗。该产品的核心技术主要为全磁悬浮血泵技术,目前取得中国和美国多项专利,属于国内首创医疗器械。与国际同类产品相比,关键性能指标已达到同等水平,血泵尺寸更小,植入侵犯性更优。该产品可满足我国在心衰外科器械治疗领域的临床需要,具有重要的社会效益。
(三十一)人工角膜:该产品由镜柱和支架组成。镜柱由聚甲基丙烯酸甲酯制成。支架由钛支架翼和聚甲基丙烯酸甲酯支架座组成。产品经环氧乙烷灭菌,一次性使用。适用于角膜移植手术难以成功的双眼角膜盲患者,包括角膜移植失败,化学伤、热烧伤、爆炸伤等引起的严重角结膜瘢痕血管化,眼睑闭锁,严重的自身免疫性疾病(如Stevens-Johnson综合征及瘢痕性类天疱疮),终末期干眼引起的角膜盲等。该产品是采用人造材料制成,无需供体角膜,有助于缓解我国角膜供体稀少的现状。产品采用分体式设计及分期植入的手术方式,人工角膜支架植入患者损坏的角膜层间,与周围角膜组织锚定;人工角膜镜柱采用螺纹结构旋入支架而固定在患者眼部,减少植入手术对患眼造成伤害的风险,有助于提高产品的在位率。必要时,镜柱可拆卸或更换。产品为传统角膜移植术禁忌症患者临床治疗提供了新的途径。
(三十二)分支型术中支架系统:该产品由支架人工血管和输送系统组成。其中支架人工血管由主体、侧支、人工血管组成。主体和侧支均由覆膜通过缝合线与多个自扩张的金属支架段缝合而成。人工血管分为涂层人工血管与无涂层人工血管,涂层人工血管上覆有牛源性胶原蛋白涂层。主体和侧支上套有包裹膜。该产品适用于Stanford A型和常规介入无法治疗的复杂Stanford B型主动脉夹层的手术治疗。 该产品是国内批准上市的第一款分支型外科手术专用支架,其侧支结构可便于支架植入左锁骨下动脉,降低手术操作难度,减少因深度游离和吻合左锁骨下动脉带来的相关风险,让更多主动脉夹层疾病患者受益。
五、其他注册管理情况
(一)境内第二类医疗器械注册审批情况
2021年,各省级药品监管部门共批准境内第二类医疗器械注册31509项,与2020年相比增加6.3%。其中,首次注册13041项,与2020年相比减少9.5%。首次注册项目占全部境内第二类医疗器械注册数量的41.4%。
延续注册11429项,与2020年相比增加24.5%,占全部境内第二类医疗器械注册数量的36.3%;变更注册7039项,与2020年相比增加16.1%,占全部境内第二类医疗器械注册数量的22.3%。
境内第二类医疗器械分项注册情况见图17。

图17 境内第二类医疗器械注册形式比例图
从注册情况看,广东、江苏、北京、湖南、浙江、河南、山东、上海、湖北、安徽10省(直辖市)注册的境内第二类医疗器械数量较多。
第二类医疗器械注册具体数据见表1及图18。

表1 境内第二类医疗器械注册表
从首次注册情况看,湖南、广东、江苏、山东、河南、浙江、北京、河北、安徽、湖北10省(直辖市)首次注册的境内第二类医疗器械数量较多。
各省第二类医疗器械首次注册数量排序图见图19。

图18 各省第二类医疗器械注册数据图

图19 各省第二类医疗器械首次注册排位图
(二)第一类医疗器械备案情况
2021年,国家药监局依职责共办理进口第一类医疗器械备案数量1854项,与2020年相比增加0.5%。
全国设区的市级药品监管部门依职责共办理境内第一类医疗器械备案数量26773项,与2020年相比减少22.7%。
(三)登记事项变更/变更备案情况
2021年,国家药监局依职责共办理进口第二、三类和境内第三类医疗器械登记事项变更/变更备案4603项,与2020年相比增加0.6%。
其中,境内第三类医疗器械登记事项变更/变更备案2455项,进口第二类、三类医疗器械登记事项变更/变更备案2148项。
各省级药品监管部门依职责共办理境内第二类医疗器械登记事项变更/变更备案10731项,与2020年相比增加31.4%。
(四)医疗器械临床试验机构备案情况
自2018年1月1日《医疗器械临床试验机构条件和备案管理办法》颁布实施以来,全国共计31个省、自治区、直辖市1074个机构完成了医疗器械临床试验机构备案工作。其中广东省、山东省、江苏省、北京市、上海市临床试验机构备案数量居全国前五名。全国医疗器械临床试验机构分布情况见图20。

图20 全国医疗器械临床试验机构备案数量
注:本报告的数据统计自2021年1月1日至2021年12月31日。

来源:国家药监局