您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-04-06 15:08
溶出度测试主要用于制药行业,作为监控剂型配方和生产过程的质量控制工具。大多数监管机构认为溶出度是大多数固体剂型的高度关键质量特征。监管机构使用溶出度测试来提供从关键生物批次到商业化产品的质量联系。监管机构也用溶出曲线的对比来进行监管变更前后的质量,如FDA的扩大和批准后变更(SUPAC)指南。
EMA、FDA、PMDA处于溶出度指导的前沿,中国NMPA对溶出度相似性要求激增,且都推荐f2相似性因子方法作为证明溶出相似性的一种手段,相对容易使用,f2值容易计算,并且已经建立了相似性的明确接受标准(即f2≥50)。f2值对应于所有指定时间点的平均差值为10%。欧盟《生物等效性指南》、FDA《口服制剂的生物利用度和生物等效性研究:一般性考虑》中规定的f2试验提供了获得额外剂量强度的体内生物等效性研究豁免的机会。在欧盟、美国和中国,在某些条件下,可以接受多介质溶出度测试和f2比较来代替生物等效性研究。
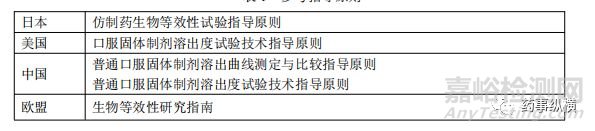
本文对FDA、EMA、NMPA、pMDA颁布的指导原则对比(见表1),进行f2相关的以下方面的对比:
1、f2相似性标准
2、f2比较豁免标准
3、f2计算所需最小时间点
4、f2计算最后时间点的确定
5、溶出量相对标准偏差
表1 参考指导原则
1f1和f2
1996年提出了两个指标因素差异因子(f1)和相似系数(f2)。为了使用这些拟合因子精确比较两个曲线,应该在足够多的时间点获得溶出结果,以充分表征溶出曲线的形状。使用这些拟合因子比较平均溶出度曲线,在每个时间点与单个剂型溶出度结果相关的可变性也必须满足某些标准。
差异因子(f1)法是计算两条溶出曲线在每一时间点的差异(%),是衡量两条曲线相对偏差的参数,计算公式如下:

其中n为取样时间点个数,Rt为参比样品(或变更前样品)在t时刻的溶出度值,Tt为试验批次(变更后样品)在t时刻的溶出度值。当测试和参比曲线相同时,f1值等于零,并且随着两个曲线变得不太相似而增加。
相似因子(f2)是衡量两条溶出曲线相似度的参数,计算公式如下:
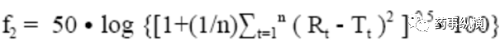
其中n为取样时间点个数,Rt为参比样品(或变更前样品)在t时刻的溶出度值,Tt为试验批次(变更后样品)在t时刻的溶出度值。
当测试和参比曲线相同时,f2值等于100,并且随着两个曲线变得不太相似,F2值呈指数下降。
2f2相似性标准
根据监管机构发布的指南,分别取受试(变更后)和参比样品(变更前)各12片(粒),测定其溶出曲线。取两条曲线上各时间点的平均溶出度值,根据上述公式计算差异因子(f1)或相似因子(f2)。
f1值达到15 (0-15)和f2值大于50 (50-100)可确保相似性或等同性。如果参比批次或试验批次的一个或多个时间点与单个溶出结果相关的可变性不符合监管机构规定的标准(通常在早期时间点的相对标准偏差≤20%,在后期时间点的相对标准偏差≤10%),则不建议计算f2统计量,需要采取其他的方式进行统计,如采用非模型依赖多变量置信区间方法进行溶出曲线比较。
3f2比较的豁免标准
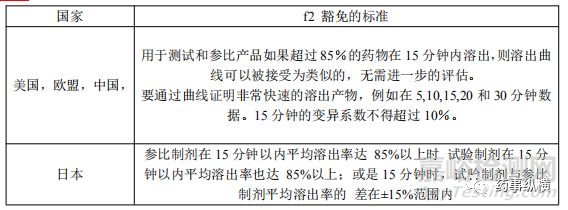
当活性药物成分在生理相关的酸碱度范围内高度可溶并且剂型表现出非常快速的溶出时,可能没有必要比较溶出曲线。非常快速溶出的的定义因国家法规指南异,如表二所示。大多数指南指出,当试验批次和参比批次在15分钟内溶出超过85%时,不需要比较溶出曲线。
表2 f2 豁免的标准
3最小时间点数
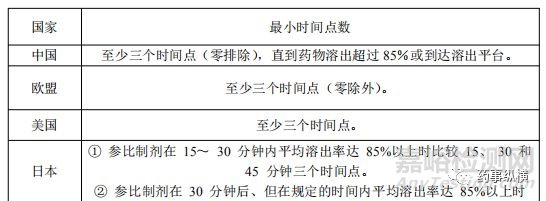
计算f2值通常至少需要三个时间点(零除外)。测试和参比产品的选定时间点必须相同。应该可能需要三个以上的时间点来充分表征溶出曲线的形状。《普通口服固体制剂溶出度试验技术指导原则》建议,对于速释产品,取样应至少每15分钟进行一次,对于快速溶出的药物制剂,可能需要以10分钟或更短的间隔期取样,以绘制获得完整的溶出曲线。对于快速溶出的药物制剂,可能需要以10分钟或更短的间隔期取样,以绘制获得完整的溶出曲线。《普通口服固体制剂溶出曲线测定与比较指导原则》提出取样时间点可为5和/或10、15和/或20、30、45、60、90、120分钟,此后每隔1小时进行测定。下表总结了f2 计算所需的最小时间点的相似性和差异。
表3 f2计算所需的最少时间点的异同

不同时间点对F2的影响也比较大,相信在平时的实验中都有体会。丁香园中有篇文章《溶出曲线f2的使用心得》详细介绍了不同取点造成F2差值,详见表4。该片文章可以仔细研读,与实际工作联系起来。
表4 不同时间点取样造成f2差异
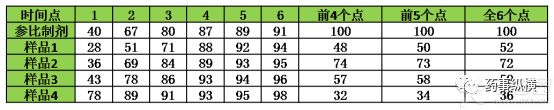
备注:该数据来源于《溶出曲线f2的使用心得》
4f2计算的最后时间点的确定
f2计算的最后时间点的确定各国指导原则也有不同规定,在溶出曲线介质时间上也有所不同。详见表5和表6
表5 溶出曲线试验截止时间点的选择
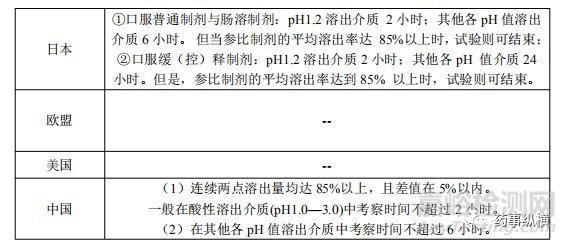
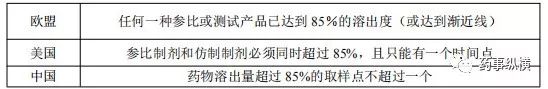
表6 f2 计算的最后时间点确定的相似性和差异

不同的取样时间点会造成不同的结果,详见表7。
表7 f2 计算的最后时间点确定的计算差异

5溶出量相对标准偏差标准
一般而言,速释产品指南规定,溶出量相对标准偏差在较早的时间点不应超过20%,在其他时间点不应超过10%。但是,有些国家的指导方针并没有明确界定立即释放或改良释放产品的早期时间点。如对于速释产品,将15分钟或更短的所有时间点定义为早期时间点可能是合适的。然而,对于缓释产品,在定义早期时间点时必须考虑溶出曲线的形状。时间本身并不是用来定义早期时间点的关键变量。如长达数小时的时间点可被视为缓释剂型的早期时间点,而15分钟可能是速释剂型的合理截止时间。
表8 f2 溶出量相对标准偏差

6汇总
从以上的汇总可以看出,FDA、EMA、NMPA、pMDA对于f2计算没有原则上的差异。pMDA《仿制药生物等效性试验指导原则》对比溶出曲线的相似除了f2的对比,还有在不同时间点的平均值的差异对比。详见表9。
表9 pMDA差异对比

7总结与分析
f2主要是溶出曲线相似性对比的工具,从实际应用来说不必拘泥于f2。目前各国监管机构对于仿制药都要进行人体生物等效性对比,从而达到临床有效性的等同,也就意味着前期处方摸索、后期的变更最终都是为了人体生物等效性。提高溶出曲线的相似性的目的之一就是为了增加通过人体生物等效性实验的概率。f2计算为对比溶出曲线相似性的工具之一,因此在实际工作中要求f2大于50只是为了增加通过人体生物等效性实验的概率。条条大路通罗马,不能只拘泥于体外溶出曲线的一致,我们要做的是增加对仿制药的了解,全面的科学理解药物溶出、吸收、代谢等,与体内状况联系起来,“不能一头栽进溶出杯”。
参考文献:
[1] 仿制药生物等效性试验指导原则(日本) 上海市药品检验所 谢沐风翻译撰写.
[2] FDA Guidance for Industry. 口服固体制剂溶出度试验技术指导原则(美国) 2009年6月CFDA药审中心组织翻译
[3] 国家食品药品监督管理总局 普通口服固体制剂溶出曲线测定与比较指导原则
[4] 国家食品药品监督管理总局 普通口服固体制剂溶出度试验技术指导原则
[5] European Medicines Agency. Committee for medicinal products for human use. Guideline on the investigation of bioequivalence
[6] 鸿林小鸟 溶出曲线f2的使用心得 丁香园
[7] Moore J, Flanner H. Mathematical comparison of dissolutionprofiles. Pharm Technol. 1996;20(6):64–74.

来源:Internet


