您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-07 10:33
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
康禾骨科1类新药获批临床。康禾生物治疗用生物制品1类新药注射用K11获国家药监局临床试验默示许可,拟用于退行性软骨磨损病变、骨关节炎等疾病的治疗。注射用K11是一款重组人成纤维细胞生长因子,它旨在通过激活FGF受体,促进软骨细胞的增殖,实现对软骨层修复的作用,以达到逆转病情的效果。
国内药讯
1.默沙东TIGIT/PD-1复方启动肺癌Ⅲ期临床。默沙东开发的TIGIT抗体vibostolimab与PD-1抑制剂帕博利珠单抗的复方制剂MK-7684A在中国登记启动一项国际Ⅲ期临床,拟评估MK-7684A联合同步放化疗后给予MK-7684A治疗不可切除的局部晚期、III期非小细胞肺癌(NSCLC)的安全性和有效性。主要研究者由上海市胸科医院医学博士傅小龙担任。此前,该新药已在中国启动针对PD-L1阳性转移性NSCLC患者一线治疗、一线治疗广泛期小细胞肺癌的Ⅲ期研究,这两项研究目前正在进行当中。
2.药明GPC-3 T细胞疗法上Ⅰ期临床。药明巨诺GPC-3靶向T细胞疗法JWATM204日前启动了首次人体试验。这项Ⅰ期临床将评估JWATM204在晚期肝细胞癌成人患者中的安全性、耐受性、剂量限值毒性以及药代动力学特征,并探索其在肝细胞癌患者中的抗肿瘤活性。JWATM204是由优瑞科公司独有的ARTEMIS®T细胞平台开发而来,药明巨诺拥有在中国(包括中国大陆、香港、澳门、台湾)及东南亚国家联盟成员国开发、生产及商业化JWATM204的许可。
3.博生吉CAR-T获批儿童实体瘤临床。国家药监局批准博生吉医药自主研发的B7-H3-CAR-T疗法TAA06注射液开展用于治疗复发/难治神经母细胞瘤(NB)的临床试验。NB是起源于原始交感神经节细胞的神经母细胞性肿瘤,通常发生于儿童,发病率位列儿童常发肿瘤第3位。该产品今年3月先后获得FDA的孤儿药资格和罕见病认定,是全球首款获批即将进入注册临床的B7-H3靶向CAR-T。
4.歌礼PD-L1抗体上HIV临床。歌礼制药宣布,由上海市公卫临床中心发起的ASC22联合西达本胺用于人类免疫缺陷病毒(HIV)感染功能性治愈临床研究日前已完成首例患者给药。ASC22是一种皮下注射的PD-L1抗体,具有重建如乙型肝炎病毒(HBV)和HIV等慢性病毒感染患者的病毒特异性免疫功能的潜力。目前,该疗法正在中美同步临床开发,正在多项临床中评估单药及联合用药用于HBV和HIV功能性治愈的潜力。
5.星汉德TCR-T疗法获FDA临床许可。星汉德⽣物新型TCR-T细胞注射液SCG101获FDA临床试验许可,即将在美国开展Ⅰ/Ⅱ期临床,评估SCG101用于治疗乙肝病毒(HBV)相关肝细胞癌(HCC)的安全性和有效性。SCG101是一款靶向HBV抗原的TCR-T疗法。此前公布在ILC 2022大会上的Ⅰ期临床数据显示,SCG101能快速、持续降低HLA-A*02:01阳性且接受过至少两轮抗肿瘤治疗的晚期乙肝病毒相关肝癌患者的血清HBsAg水平,疾病控制率达到66%。
国际药讯
1.卫材/渤健AD抗体获FDA优先审评资格。FDA授予卫材与渤健联合开发的阿尔茨海默病(AD)在研疗法lecanemab优先审评资格,PDUFA日期为明年1月6日。Lecanemab能与β淀粉样蛋白的可溶性寡聚体特异性结合,旨在中和和清除AD患者大脑中具有毒性的可溶性寡聚体。在概念验证性IIb期临床(Study 201) 中,lecanemab(10mg/kg)在18个月时使患者脑淀粉样蛋白减少0.306SUVr单位(基线平均值为1.37);并且淀粉样蛋白减少的程度与ADCOMS、CDR-SB和ADAS-cog的临床下降更慢相关。
2.武田HAE新药儿科Ⅲ期临床积极。武田制药在EAACI2022年会上公布拉那芦人单抗注射液(Takhzyro)用于2-12岁患者预防遗传性血管水肿(HAE)发作的Ⅲ期SHP643-301研究(SPRING,NCT04070326)阳性结果。与基线相比,Takhzyro预防性治疗将儿童HAE发作率平均降低94.8%,从每月1.84次降至治疗期间的0.08次。在52周治疗期间,大多数患者(76.2%)没有发作,平均99.5%的天数没有发作。研究结果与在成人和青少年HAE患者中开展的早期研究一致。
3.HER2双抑制组合mCRC关键临床积极。Seagen公司HER2抑制剂Tukysa(tucatinib)单药或与抗HER2抗体trastuzumab联用,在治疗HER2阳性、转移性结直肠癌(mCRC)经治患者的关键Ⅱ期临床(MOUNTAINEER)获积极结果。单药组达到3.3%的客观缓解(95% CI:0.1-17.2),疾病控制率为80.0%;联合治疗达到38.1%的确定客观缓解(95% CI:27.7-49.3),中位DoR为12.4个月(95% CI:8.5-20.5),中位PFS为8.2个月(95% CI:4.2-10.3),中位OS为24.1个月(95% CI:20.3-36.7)。此外,Tukysa单药或联合治疗的总体耐受性良好。
4.DNA聚合酶抑制剂临床前研究积极。IDEAYA公司潜在“first-in-class”DNA聚合酶抑制剂小分子新药,联合葛兰素史克PARP抑制剂niraparib在临床前研究中获积极结果。联合用药在多种癌症模型中均显示出肿瘤消退和持久的治疗响应。IDEAYA新药主要靶向DNA聚合酶Theta的解旋酶结构域,属于合成致死疗法。IDEAYA与葛兰素史克此前已达成合作协议,将评估该分子与niraparib联合治疗携带BRCA突变或其他同源重组突变/缺陷的肿瘤患者的疗效。
5.突破性疗法CD3单抗上市审批遭FDA延期。FDA延长Provention公司CD3单抗teplizumab用于延缓高危个体1型糖尿病(T1D)的生物制品许可申请(BLA)的审查期,新的PDUFA日期为2022年11月17日。FDA认为Provention提交的额外数据是对BLA的重大修正,需要额外的时间来进行审查。在一项Ⅱ期临床(NCT01030861)中,2周疗程teplizumab治疗可将T1D的发病时间平均推迟2年。此前FDA已授予teplizumab突破性疗法资格和优先审评资格。
6.阿斯利康逾12亿美元收购TeneoTwo。阿斯利康宣布将收购生物技术公司TeneoTwo,并获得该公司一款临床早期的CD19/CD3 T细胞接合剂TNB-486。阿斯利康计划加速推进这款治疗性抗体用于B细胞血液系统恶性肿瘤的临床开发,包括弥漫性大B细胞淋巴瘤和滤泡性淋巴瘤。根据协议,TeneoTwo将获得1亿美元预付款,最高8.05亿美元的研发相关里程碑付款和高达3.6亿美元的商业相关里程碑付款。
医药热点
1.阿斯利康新冠长效抗体获准进入中国大陆。海口海关所属博鳌机场海关日前为中国大陆首次进口的阿斯利康新冠中和抗体Evusheld(AZD7442、恩适得)完成入境特殊物品审批,货值共计2198.02万元人民币。这是全球唯一一款可用于新冠感染预防的药物,在海南博鳌乐城国际医疗旅游先行区通过特殊进口审批获先行先试准入。据悉,恩适得落地医院为博鳌乐城瑞金海南医院。
2.我国人均预期寿命提高到77.93岁。国家卫健委于7月5日召开新闻发布会,介绍健康中国行动实施以来进展与成效。健康中国行动推进委员会办公室副主任、国家卫生健康委规划司司长毛群安介绍:目前,我国人均预期寿命提高到77.93岁,主要健康指标居于中高收入国家前列,《“健康中国2030”规划纲要》2020年阶段性目标总体如期实现,健康中国行动2022年主要目标提前实现。
3.流感疫苗接种降低老年人阿尔茨海默病风险。近日,得克萨斯大学休斯顿健康科学中心(UTHealth at Houston)一项基于对近200万人医疗数据的最新研究显示,在65岁以上的老年人中,与未接种过流感疫苗的人群相比,接种过至少一剂流感疫苗的人群阿尔茨海默病的发病风险降低40%,而且接种次数越多,阿尔茨海默病风险越小。
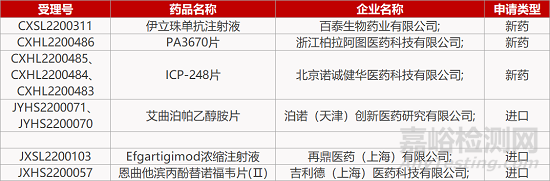
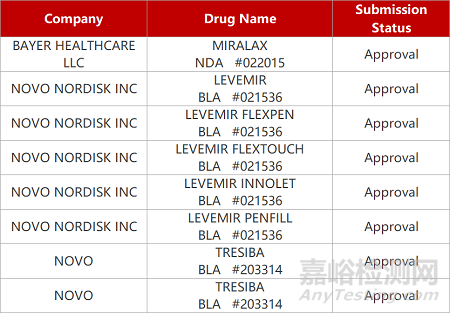
评审动态

来源:药研发


